

气体 | 试剂 | 制备装置 | 收集方法 | 操作 | |
A | O2 | KMnO4 | a | e | 若出现倒吸现象,应立即停止加热 |
B | H2 | Zn+稀H2SO4 | b | e | 试管中加入几粒胆矾可加快反应速率 |
C | HCl | 浓硫酸+浓盐酸 | b | c | 试管中为浓盐酸、分液漏斗为浓硫酸 |
D | NH3 | NH4Cl+NaOH | a | d | 可用湿润的蓝色石蕊试纸验满 |
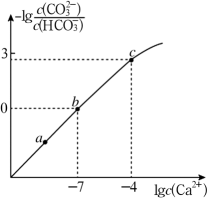
已知:①镓(Ga)和铝同主族,具有相似的化学性质。
②25℃时,。




下列说法错误的是( )
实验目的 | 玻璃仪器 | 试剂 | |
A | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管、玻璃棒 | ①饱和氯化铁溶液②蒸馏水 |
B | 用银氨溶液检验葡萄糖中醛基 | 试管、烧杯、酒精灯、胶头滴管 | ①AgNO3溶液、浓氨水②葡萄糖溶液③蒸馏水 |
C | 除去粗盐水中的Ca2+、Mg2+、 | 胶头滴管、试管、烧杯、漏斗、玻璃棒 | ①粗盐水②氯化钡溶液③碳酸钠溶液④氢氧化钠溶液⑤稀盐酸 |
D | 制备乙酸乙酯 | 酒精灯、试管、导管 | ①乙醇②浓硫酸③乙酸④碎瓷片⑥饱和碳酸钠溶液 |


已知:“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。下列说法正确的是
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO的空间构型为,TeO
中碲原子的杂化类型是。
③H2O、H2S、H2Se、H2Te的键角依次(填“变大”、“变小”或“不变”)。

Cu+填充了晶胞中四面体空隙的百分率是,S2-配位数为。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为。若晶胞参数a nm,晶体的密度为d g·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。

已知:γ-Al2O3能与酸反应,α-Al2O3不与酸反应。
回答下列问题:
①发生上述转化反应的电极应接电源的极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成(填化学式)。

a.与FeCl3溶液作用显紫色
b.含有醛基、羟基和醚键
c.存在含有苯环和碳碳双键的酯类同分异构体
资料ii.![]()
![]()

P、Q的分子式都是C6H11ON,生成尼龙6的化学方程式是。

写出H2还原NO反应的热化学方程式。
实验编号 | 起始浓度c/(mol·L-1) | 生成N2的起始反应速率V(mol·L-1·s-1) | |
NO | H2 | ||
a | 6.00×10-3 | 1.00×10-3 | 3.18×10-3 |
b | 6.00×10-3 | 2.00×10-3 | 6.36×10-3 |
c | 1.00×10-3 | 6.00×10-3 | 0.53×10-3 |
d | 3.00×10-3 | 6.00×10-3 | 4.77×10-3 |
①该反应的速率方程为(速率常数用k表示,不必求出k值)。
②实验d测得体系的总压强p随时间t的变化如下表所示:
t/ min | 0 | 10 | 20 | 30 | 40 |
p/kPa | 36 | 33.8 | 32 | 30.4 | 30.4 |
t=20min时,体系中P(H2)=kPa,v=mol·L-1·s-1(速率常数k=8.83×104mol-2· L-1· s-1 , 计算结果保留2位小数)。
甲 | 乙 | 丙 | |
n(H2 )/( mol) | 1 | 2 | 3 |
n(NO)/( mol) | 1 | 1 | 1 |

①“催化剂表面H2还原NO反应”选择的合适条件是。
②在200℃,丙容器中的H2(g)和NO(g)发生反应,测得体系的平衡压强与起始压强之比为3.52:4,则NO的有效去除率为。