
选项 | 试剂a | 试剂b | 试剂c |
A | 浓盐酸 | KClO3 | AgNO3溶液 |
B | 浓H2SO4 | 少量蔗糖 | AlCl3溶液 |
C | 浓氨水 | CaO | MgCl2溶液 |
D | 稀HCl | CaCO3粉末 | 饱和Na2CO3溶液 |
乙烯![]()
乙二醇
聚乙二醇
选项 | 事实 | 解释 |
A | NH3的热稳定性比PH3强 | NH3分子间能形成氢键 |
B | 基态Fe3+比Fe2+稳定 | 基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构 |
C | 石墨能够导电 | 石墨是离子晶体 |
D | CH4与H2O分子的空间构型不同 | 它们中心原子杂化轨道类型不同 |
选项 | 实验操作和现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入X气体,出现白色沉淀 | X气体一定具有强氧化性 |
B | 将石蜡油高温分解产物通入酸性KMnO4溶液,溶液褪色 | 分解产物中一定有乙烯 |
C | AgNO3标准液滴定未知浓度NaCl溶液时,用K2CrO4作指示剂 | Ksp(AgCl)<Ksp(Ag2CrO4) |
D | 常温下,分别测定浓度均为0.1 mol·L-1NaF和NaClO溶液的pH,后者大 | 酸性:HF>HClO |




已知:①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
回答下列问题:
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=-571.6 kJ·mol-1
则③CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH=。

①若N点压强为1 MPa,则平衡常数Kp(N)=MPa-2 , P点与N点的平衡常数K(P)K(N)(填“>”、“<”或“=”)。
②若无催化剂,N点平衡转化率(填“是”或“否”)可能降至R点?理由是:。

步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是,其侧管的作用为。
②a中制备Na2FeO4反应的离子方程式为。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过方法进一步提纯。

已知:+4I-+8H+=Fe2++2I2+4H2O;I2+2
=
+2I-。
①含有2种官能团,其中一种为-NH2
②1mol该有机物可与0.5molNa2CO3反应
③苯环上有四个取代基,分子中不同化学环境的氢原子数目比为6:2: 2:1
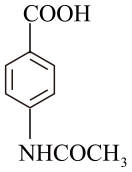 的合成路线。
的合成路线。
