





①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
下列说法错误的是( )
I.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0kJ·mol-1
III.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3

①该反应达平衡状态的依据是(填序号)。
A.v正(CH3OH)=3v逆(H2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体总物质的量不变
②3min时,反应的v正v逆(填“<”、“>”或“=”)。0~10min内,用H2表示的平均反应速率v=。
序号 | 温度 | 催化剂 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | Cu2O(I) | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | Cu2O(II) | 0.050 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | Cu2O(II) | 0.050 | 0.044 | 0.040 | 0.040 | 0.040 | 0.040 |
可以判断:实验温度T1T2(填“>”、“<”,下同);催化剂的催化效果Cu2O(I)Cu2O(II)。


①实验时,先在大试管中加入B、浓硫酸、D的混合物,再加入。
②反应结束后,将收集到的产品倒入分液漏斗中振荡、静置、分液,从分液漏斗上口倒出。
③相对于a装置,用b装置进行制备的缺点有(答一条即可)。

①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程式为。
②X、Y、Z均为上述元素中的同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为。
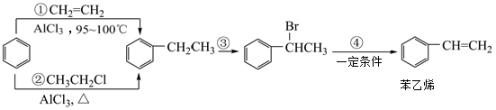
①以CH2=CH2为原料制备CH3CH2Cl:;
②用苯乙烯合成聚苯乙烯:。
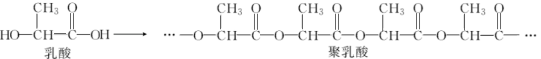
①写出乳酸与足量金属钠反应的化学方程式:。
②聚乳酸中含有的官能团名称为。
③分析用聚乳酸塑料替代聚苯乙烯塑料的好处是。
![]() (g)⇌
(g)⇌ (g)+H2(g) ΔH
(g)+H2(g) ΔH
已知键能数据如下:
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJ•mol﹣1 | 412 | 348 | 612 | 436 |
注:25℃,100kPa时生成或断裂1mol化学键所放出或吸收的能量称为键能。计算上述反应的ΔH=。

①若用于粗铜的精炼,装置中电极C是(填“粗铜”或“纯铜”),工作一段时间后,电解质CuSO4溶液的浓度将(填“增大”“减小”或“不变”)。
②若用于电镀金属银,则电镀液宜使用溶液,镀件是(填“C”或“D”)。
|
离子 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
|
|
|
含量/mg·L-1 |
9360 |
83 |
200 |
1100 |
16000 |
1200 |
118 |
①淡化过程中在室中易形成水垢[主要成分CaCO3和Mg(OH)2],该室中除发生电极反应外,还发生反应的离子方程式为。
②产生淡水的出水口为 (选填“e”、“f”、“j”)。