
B .
B . 
C .
C . 
D .
D . 



a.酸性 b.吸水性 c.氧化性 d.脱水性
①如图是氢氧化钠溶液与盐酸反应的示意图,用实际参加反应的离子符号来表示该反应的式子可写为。

②若向稀氢氧化钠溶液中滴入几滴酚酞溶液,然后再向其中滴入稀盐酸至过量,则观察到溶液颜色的变化是。
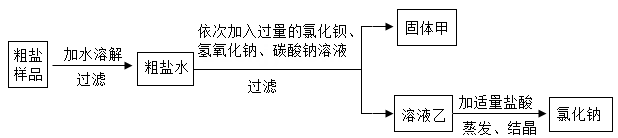
①溶解、过滤、蒸发的操作中都需要用到的一种玻璃仪器为(填“烧杯”“漏斗”或“玻璃棒”)。
②固体甲中所含有的难溶性物质为BaSO4、、CaCO3和BaCO3。
③请设计实验验证溶液乙中所含有的杂质。(简要叙述实验步骤及现象)