


 ),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是( )
),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是( )

气体 | 液体 | 固体 | |
A | Cl2 | FeCl2溶液 | Cu |
B | Br2 | FeI2浓溶液 | Fe |
C | HCl | Na[Al(OH)4]溶液 | Al(OH)3 |
D | NH3 | H2O | Cu(OH)2 |

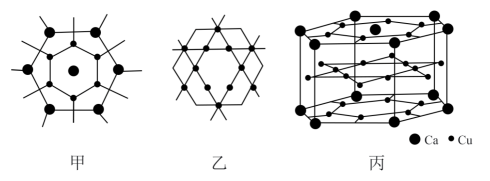
下列说法正确的是( )
选项 | 操作 | 目的 |
A | 乙醇与浓硫酸加热至170℃,将产生的气体通入酸性高锰酸钾溶液 | 验证产物乙烯具有还原性 |
B | 向粗盐水中依次加入过量的BaCl2、NaOH、Na2CO3溶液,静置过滤,最后向滤液中滴加盐酸至无气泡产生 | 精制食盐水 |
C | 将醋酸与碳酸钠溶液反应后产生的气体通入苯酚钠溶液中 | 比较醋酸、碳酸、苯酚酸性 |
D | 淀粉溶液中加入几滴稀硫酸,水浴加热,充分反应后加入NaOH溶液调节至碱性,再加入银氨溶液,水浴加热· | 检验淀粉水解产物含有醛基 |

已知:R-ClRMgCl
 (R、R′表示烃基)
(R、R′表示烃基)
![]()

回答下列问题:
a.苯环上有2个取代基,无其它环状结构
b.能与NaHCO3溶液发生反应
c.能发生水解反应
 )和3-氯己烷为原料制备
)和3-氯己烷为原料制备 的合成路线。
的合成路线。

A.sp2 B.sp3 C.sp3d D.sp3d2

①氯气和氨气在丙酮中生成丙酮联氮[(CH3)2C=NN=C(CH3)2]且有白烟生成。
②丙酮联氮水解可得到丙酮和水合肼(N2H4•H2O)。

按照接口顺序a→ → → → ←d进行实验,反应前先通入一段时间的氮气排出空气,丙酮中生成丙酮联氮的化学方程式为。

量取水解液50.0mL加水调至弱碱性,配成250mL溶液,移出25.00mL,再加入足量AgNO3溶液;充分反应后,过滤、洗涤、干燥、称量,得固体质量为0.216g。则水解液中肼的含量为g•L-1。
 )是重要的化工原料,常用于制造聚乙烯醇缩醛、耐汽油管道、粘合剂等。其制备的工业流程如图所示:
)是重要的化工原料,常用于制造聚乙烯醇缩醛、耐汽油管道、粘合剂等。其制备的工业流程如图所示:
已知:①电石气中通常含有H2S、PH3等杂质②电石气通入次氯酸钠溶液后反应后,溶液仍澄清③乙炔较易与羧酸反应生成酯
回答下列问题: