 C . 量取液体
C . 量取液体 D . 加热液体
D . 加热液体

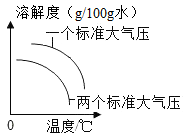 气体物质的溶解度与温度和压强的关系
B .
气体物质的溶解度与温度和压强的关系
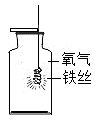
B .  一定量的镁在过量氧气中充分燃烧
C .
一定量的镁在过量氧气中充分燃烧
C . 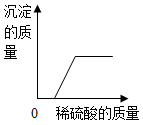 向NaOH和BaCl2的混合溶液中加入足量的稀硫酸
D .
向NaOH和BaCl2的混合溶液中加入足量的稀硫酸
D .  高温煅烧一定质量的石灰石
高温煅烧一定质量的石灰石
选项 | 实验目的 | 实验方案 |
A | 配制100g质量分数为5%的NaCl溶液 | 向盛有5.0g NaCl固体的烧杯中,加入100g水,搅拌 |
B | 除去CaCl2溶液中少量的盐酸 | 加入过量的CaCO3 , 过滤 |
C | 鉴别碳粉、铁粉、氧化铜三种固体 | 取样,分别滴加稀盐酸,观察现象 |
D | 检验CO2中混有的少量O2 | 将带火星的木条伸入气体中 |
Ⅰ、四氯化碳有种元素组成。
Ⅱ、金刚石中碳元素以(选填“化合态”或“游离态”)存在,化合物X的化学式是。
体 积 | |||
0℃/101kPa | 20℃/101kPa | 0℃/202kPa | |
16g甲烷 | 22.4L | 24.0L | 11.2L |
Ⅰ、甲烷属于(选填“有机物”或“无机物”)。
Ⅱ、16g甲烷中约含个甲烷分子(用科学记数法表示)。
Ⅲ、压强变大,甲烷分子间的间隔(选填“变大”、“变小”或“不变”)。
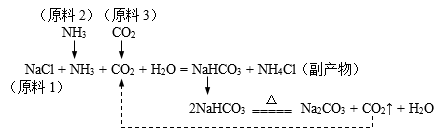
Ⅰ、Na2CO3的类别属于(选填“酸”、“碱”或“盐”);副产品NH4Cl可作(选填“氮”、“磷”或“钾”)肥。
Ⅱ、制纯碱的过程中,可以循环利用的物质是。

Ⅰ、0℃时,碳酸氢钠的溶解度是。
Ⅱ、20℃时,将20g氯化钠加入50g水中,充分溶解后得到(填“饱和”或“不饱和”)溶液。
Ⅲ、产物中NaHCO3比NH4Cl先结晶析出。结合①中生产原理及溶解度曲线解释其原因。

Ⅰ、纯碱样品中碳酸钠的物质的量为。
Ⅱ、实验中个别同学过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该纯碱样品中碳酸钠的质量分数(选填“偏大”、“不变”或“偏小”)。
Ⅰ、锌粉与硝酸铜反应的化学方程式是。
Ⅱ、若取少量滤液于试管中,滴加稀盐酸,产生白色沉淀,则滤液中溶质的成分是(用化学式表示)。
Ⅲ、若滤渣中含有两种金属,则a的取值范围是。
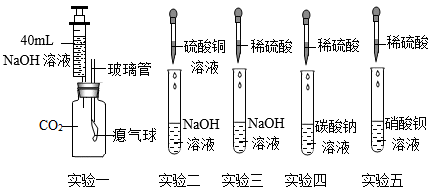
Ⅰ、实验一中,将注射器中氢氧化钠溶液全部推入集气瓶中,过一会儿观察到气球鼓起。甲同学认为二氧化碳与氢氧化钠发生了反应;乙同学认为该实验不严谨,于是将该注射器中氢氧化钠溶液换成,做了对比实验,从而证明二者发生了反应。
Ⅱ、实验二中,反应的化学方程式为。
Ⅲ、取少量实验三中的剩余溶液,滴加几滴酚酞试液,溶液呈无色,证明稀硫酸与氢氧化钠溶液能发生反应。该实验方案是否可行,并说明理由。
Ⅳ、将实验四、实验五两支试管反应后的物质倒入同一洁净的烧杯中,充分反应后过滤,得到无色滤液和白色沉淀。同学们对白色沉淀的成分继续进行了实验。
实验操作 | 实验现象 | 实验结论 |
取少量白色沉淀于试管中,加入足量的稀盐酸 | 白色沉淀是BaSO4、BaCO3 |
实验结束后,同学们对废液进行了回收和处理。


Ⅰ、实验中证明有水生成的现象是。
Ⅱ、乙中澄清石灰水的作用是检验二氧化碳,该反应的化学方程式为。
Ⅲ、要证明有CO生成,在不连接其他装置的情况下,可进行的操作是。