①提取有效成分 ②广泛应用 ③测定结构 ④确定组成 ⑤获得晶体 ⑥合成与修饰 ⑦研究的缘起
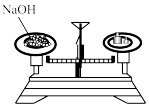 B . 过滤
B . 过滤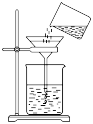 C . 将剩余钠放回试剂瓶
C . 将剩余钠放回试剂瓶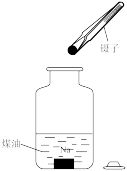 D . 转移溶液
D . 转移溶液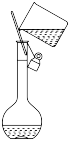

选项 | 实验操作、现象 | 结论 |
A | 将湿润的有色布条放入充满氯气的集气瓶中,布条褪色 | 氯气具有漂白性 |
B | 向次氯酸钙溶液中通入过量CO2气体,无沉淀产生 | 酸性:HClO> H2CO3 |
C | 盛有氯气的试管倒扣在水槽中,静置一段时间后,试管中液面上升一段距离 | 氯气能溶于水 |
D | 用小刀切割金属钠,钠表面光亮的银白色迅速变暗 | 金属钠质软,易与水反应生成NaOH |

① c= ×100%
② c=
③ 若上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5w
④ 将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1 , 则加入水的体积应小于50 mL
|
××医院化验单 |
|||
|
姓名:××× |
|||
|
项目 |
测定值 |
单位 |
参考范围 |
|
丙氨酸氨基转氨酶ALT |
35 |
U/L |
9~50 |
|
血清葡萄糖GLU |
216↑ |
mg/dl |
60~110 |
|
甘油三酯TG |
217↑ |
mg/dl |
50~200 |
|
总胆固醇TCH |
179 |
mg/dl |
150~220 |
|
注:1dl=100mL |
|||
84消毒液 【有效成分】NaClO 【规格】1 000 mL 【质量分数】25% 【密度】1.192 g·cm-3 【使用方法】稀释100倍(体积比)后使用 |
①请计算配制此溶液需称取NaClO固体的质量为g 。
②如图所示的仪器中配制溶液需要使用的是(填字母),还缺少的玻璃仪器是。

溶液取用情况 | 溶液中存在的主要离子及其浓度 |
示例:只取溶液C | Na+ 和OH-物质的量浓度均为0.3mol·L-1 |
等体积混合溶液B和C | ① |
溶液A和D按体积比2:1混合 | ② |
③ | Ba2+物质的量浓度为0.1mol·L-1 , OH-物质的量浓度为0.2mol·L-1 |
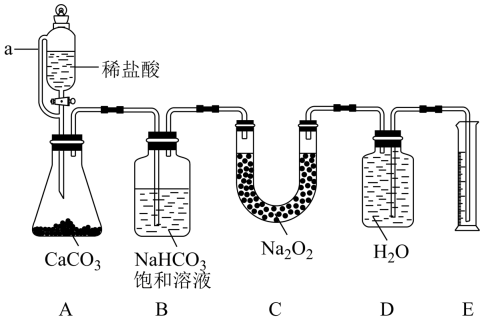
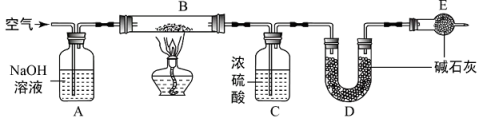
【资料】
a.浓硫酸常用于吸收水蒸气;
b. 碱石灰是固体氢氧化钠和氧化钙的混合物。
①点燃酒精灯 ②熄灭酒精灯 ③连接上D、E装置 ④通入一段时间的空气 ⑤再通入一段时间的空气