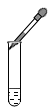
 添加液体
B .
添加液体
B . 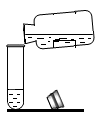 倾倒液体
C .
倾倒液体
C . 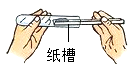 装入粉末状固体
D .
装入粉末状固体
D . 
选项 | 实验目的 | 实验设计 |
A | 除去粗盐中的泥沙 | 溶解、蒸发、结晶 |
B | 检验二氧化碳中混有盐酸 | 将气体通入紫色石蕊试液中 |
C | 稀释浓硫酸 | 将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌 |
D | 比较锌、铁、铜的金属活动性 | 将锌片和铁片分别插入硫酸铜中 |
A.一氧化碳 B.肥皂水 C.干冰 D.氢氧化钠 E.甲烷

①图中a=
②硫原子核外有个电子。
③氧元素和硫元素的化学性质(填“相似”或“不相似”)。

①该反应前后没有发生变化的微粒是(填微粒符号)。
②该反应的化学方程式为。


|
实验内容 |
实验现象 |
结论与解析 |
|
⑴将少量氢氧化钙粉末加入试管中,加入1mL的水振荡摇匀再滴入两滴酚酞溶液,观察现象。 |
溶液浑浊,溶液变成红色 |
氢氧化钙微溶于水,pH7(填“>”、“<”或“=”) |
|
⑵向实验⑴的试管中滴加足量的盐酸,观察现象。 |
浑浊的溶液变澄清,并由红色变成色。 |
酸碱发生中和反应 |
|
⑶取2mL久置于空气中的氢氧化钠溶液加入试管中,滴加硝酸钡溶液,观察现象。 |
反应产生 |
说明氢氧化钠变质原因(用化学方程式表示),所以氢氧化钠固体必须保存。 |

I.酚酞的变色范围是pH8.2~10.0,且酚酞在强碱性溶液中红色会褪去。
II.次氯酸(HClO)和次氯酸钠(NaClO)都具有漂白性,都能使有色溶液褪色,但次氯酸在光照条件下不稳定会分解生成盐酸和氧气。
III.氯气与氢氧化钠反应,生成次氯酸钠、一种生活中常用做调味品的物质和水。
IV.氯气是一种黄绿色、有刺激性气味的气体且有毒,会污染环境,氯气溶于水得到黄绿色溶液且与水反应生成盐酸和次氯酸。
V.次氯酸钠与浓度较大的盐酸反应,放出黄绿色气体和生成两种生活中常见的物质。

反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验。
操作 | 现象 |
a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
操作 | 现象 |
c.取 mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有性。获得这个结论的实验依据是。
①操作b溶液变成黄绿色的原因:。
②有同学认为由操作b获得上述结论并不严谨,该同学的理由是:。 请设计进一步确认此结论的实验方案。