



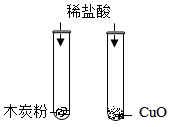
 图Ⅰ鉴别木炭粉和CuO粉末
B .
图Ⅰ鉴别木炭粉和CuO粉末
B .  图Ⅱ除去一氧化碳中的水蒸气
C .
图Ⅱ除去一氧化碳中的水蒸气
C .  图Ⅲ检验待测液呈碱性
D .
图Ⅲ检验待测液呈碱性
D .  图Ⅳ除去NaCl溶液中少量的Na2CO3
图Ⅳ除去NaCl溶液中少量的Na2CO3
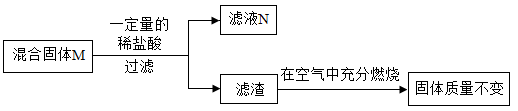
关于该实验有如下说法:
①若滤液 N为浅绿色,则混合物 M中一定有氧化亚铁。
②若固体粉末M含有铁,则m可能等于n。
③若充分反应后滤液N中含有四种阳离子,则滤渣一定为纯净物。
④若充分反应后滤液N中含有四种阳离子,则固体粉末M至少由四种物质组成。
⑤滤液N中一定含有氯化锌,可能含有氯化亚铁和氯化铜。
⑥混合物 M中一定有木炭粉,不能确定是否含有氧化亚铁和氧化铜。
其中说法正确的个数是( )
温度℃ | 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度 /g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 138.0 | 169.0 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | |
Ce2(SO4)3 | 24.1 | 20.0 | 17.2 | 14.0 | 10.0 | 8.9 | 8.3 | 7.1 | 6.0 |
请回答下列问题:

已知:二氧化硅不溶于稀盐酸
a.Na2CO3溶液 b.NaOH溶液 c.石灰乳 d.Ba(OH)2溶液

【查阅资料】①硫酸亚铁铵晶体在200℃完全失去结晶水,剩余物在500℃完全分解为氧化铁、SO2、SO3、NH3和H2O。②1400℃后氧化铁能续继分解。③碱石灰是由NaOH和CaO混合制成,不仅能吸收水蒸气,还能吸收SO2、SO3、CO2、HCl等酸性气体。

温度/℃ | 室温 | 200 | 500 |
B装置/g | 200.00 | 221.6 | 255.60 |
C装置/g | 100.00 | 100.00 | m |
①根据图示数据,m=;硫酸亚铁铵晶体中,a:b:c:x=。
②写出B点的化学式。
③F点剩余固体物质的化学式为。
