周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
选项 | 探究方案 | 探究目的 |
A | 向盛有 |
|
B | 向盛有 |
|
C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |
|
D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |
|

已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。

(水层)+3HA(有机层)
(有机层)+
(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是。
②反萃取的目的是将有机层转移到水层。使
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有(填化学式)。
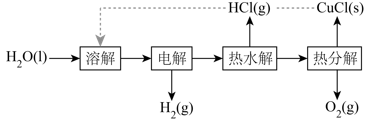
①电解在质子交换膜电解池中进行。阳极区为酸性溶液,阴极区为盐酸,电解过程中
转化为
。电解时阳极发生的主要电极反应为(用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有(填元素符号)。
①实验中发现,在时,密闭容器中
溶液与铁粉反应,反应初期有
生成并放出
, 该反应的离子方程式为。
②随着反应进行,迅速转化为活性
, 活性
是
转化为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为。

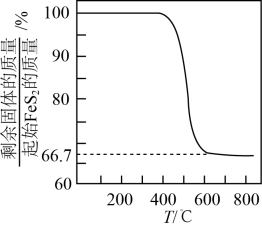
③在其他条件相同时,测得Fe的转化率、的产率随
变化如题图所示。
的产率随
增加而增大的可能原因是。
