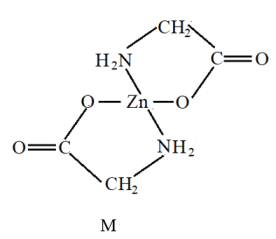
|
|
|
|
A. | B.烧瓶 | C.坩埚 | D.锥形瓶 |
 B .
B .  C .
C . 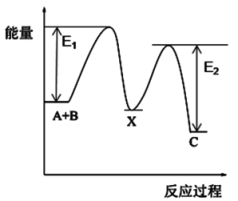 D .
D . 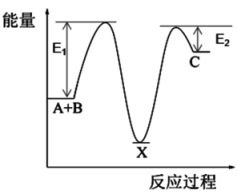
|
|
|
|
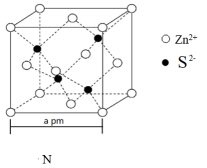
A.XY | B.XY2 | C.XY3 | D.X2Y |


选项 | 粒子 | 空间结构 | 解释 |
A | SO2 | V形 | S原子采取sp2杂化 |
B | BF3 | 三角锥形 | B原子采取sp3杂化 |
C | C2H4 | 平面三角形 | C原子采取sp2杂化 |
D | ClO | 四面体形 | Cl原子采取sp3杂化 |


![]()
已知:①230℃时,该反应的正反应平衡常数K远小于逆反应平衡常数K’②Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
下列判断正确的是( )

目的 | 方案设计 | 现象与结论 | |
A | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推压缩体积 | 观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动 |
B | 铜的电解精炼 | 待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解 | 阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变 |
C | 制备[Cu(NH3)4]SO4·H2O晶体 | 向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体 | 反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+ |
D | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化 |
羧酸 | pKa |
乙酸(CH3COOH) | 4.76 |
三氯乙酸(CCl3COOH) | 0.65 |
酸性比较:乙酸三氯乙酸(填“>”、“<”或“=”),并说明原因:;
已知:① CO2(g)+4H2(g) = CH4(g)+2H2O(l) △H1 = -252.9 kJ/mol
②2H2O(l) = 2H2(g)+O2(g) △H2 = +571.6 kJ/mol
③ H2O(l) = H2O(g) △H3 = +44.0 kJ/mol
回答下列问题:
①下列操作顺序是:()→()→()→ A→C→()→()(用序号字母填写)
A.移取20.00 mL待测水样注入洁净的锥形瓶中,并加入2~3滴K2Cr2O7试液
B.重复实验2次
C.把锥形瓶放在滴定管的下面,垫上白纸
D.在清水洗涤后,用标准溶液润洗滴定管2~3次
E.取标准液注入滴定管至刻度线0以上2~3cm,并固定在铁架台上
F.用标准液滴定至溶液出现砖红色沉淀时,停止滴定,并记下滴定管液面的刻度V2
G.排气泡后,记下读数V1
②盛装上述待测液和标准液需要用到的滴定管分别为和 (填“甲”或“乙”)

③下列操作或误差判断正确的是
A.滴定过程中,眼睛始终注视锥形瓶中溶液颜色的变化
B.锥形瓶清洗后需要用待测水样润洗2~3次
C.滴定完成后,俯视滴定管读数,会造成滴定结果偏高
D.若滴定结束发现滴定管中出现气泡,则使结果偏低
④实验数据如下表:
实验次数 | 滴定前读数/mL | 滴定前读数/mL |
1 | 0.10 | 12.22 |
2 | 1.25 | 13.37 |
3 | 0.82 | 14.52 |
则:该水样中Cl-物质的量浓度是mol/L
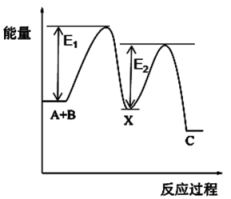
已知:反应Ⅰ N2O(g) + CO(g) N2(g) + CO2(g) ΔH<0
第一步:Fe+ + N2O → FeO+ + N2
第二步:FeO++ CO → Fe+ + CO2
反应过程的能量变化如图所示:

①决定总反应速率的是(填“第一步”或“第二步)
②下列有关说法正确的是
A.Fe+改变反应历程,也改变了反应的ΔH
B.升高温度,CO2的体积分数减小
C.FeO+是中间产物,也可叫作催化剂
D.第二步反应中有极性共价键的断裂和形成
①关于反应Ⅰ在不同温度下,达到平衡时有:Δv (500 K) Δv (550 K)(填“>”、“<”或“=”)
②反应Ⅰ的平衡常数为K1 , 请在图中画出pK(pK=—lgK1)随温度(T)的变化趋势