



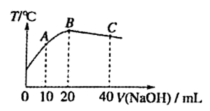



a.CO燃烧 b.铝和稀盐酸反应 c.碳酸氢钠溶于水 d.石灰石分解
| 化学反应 |
正反应活化能 |
逆反应活化能 |
t℃时平衡常数 |
| N2(g)+O2(g)=2NO(g) △H>0 |
akJ/mol |
bkJ/mol |
K1 |
| 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 |
ckJ/mol |
dkJ/mol |
K2 |
请写出t℃时,NH3被NO氧化生成无毒气体的热化学方程式(反应热用a、b、c、d代数式表示)。t℃时,该反应的平衡常数(用K1和K2表示)。
②在25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c(NH)=c(Cl-),则溶液显 (填“酸“碱”或“中”)性。
化学式 | H2CO3 | HClO | H2SO3 |
电离平衡常数 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是。
②下列说法正确的是。
A.Ca(ClO)2溶液中通入少量SO2:SO2 + H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH−)降至1.0×10-7mol/L时,溶液中的=0.6
C.等物质的量浓度的NaHSO3与Na2SO3混合液中,3c(Na+)=2c()+2c(
)+2c(H2SO3)
D.Na2CO3溶液中加入少量水,则溶液中将减小
③根据表中数据,计算0.03 mol/L NaClO溶液的pH≈。
反应Ⅰ:2CO2(g) + 6H2(g)CH2=CH2(g) + 4H2O(g) ΔH1= -246.4 kJ/mol
反应Ⅱ:CO2(g) + 4H2(g) CH4(g) + 2H2O(g) ΔH2= -166.8 kJ/mol
某催化剂作用下,在容积为2.0 L的恒容密闭容器中充入1mol CO2和3mol H2 , 体系中主要发生上述反应Ⅰ和反应Ⅱ两个竞争反应。反应进行t min时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应(填“Ⅰ”或“Ⅱ”);840℃之后,C2H4产量下降的原因是。520℃时,0~t min内用氢气表示反应Ⅱ的平均反应速率:v(H2)= mol/(L·min) (用含t的代数式表示)。

①上述反应自发的条件是。
②在a L密闭容器中,充入不同氢碳比的原料气体,控制温度600 K,发生反应Ⅲ,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势。

③一定条件下,将1 mol CO2和1 mol H2置于恒容密闭容器中,发生反应Ⅲ,下列能说明反应达到平衡状态的是。
A.混合气体的密度保持不变
B.CO2的消耗速率与 H2O的消耗速率相等
C.CO2的体积分数保持不变
D.混合气体的平均相对分子质量保持不变
①取标况下1000mL尾气样品,通入适量NaOH溶液中;
②配制成250mL溶液;
③准确量取25.00mL;
④将25.00mL溶液置于锥形瓶中;
⑤用0.0100mol/L的酸性KMnO4溶液进行滴定,消耗酸性KMnO4溶液VmL。
