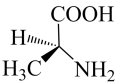
 是手性分子
C .
是手性分子
C . 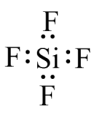 D . 氧元素基态原子的电子排布图为:
D . 氧元素基态原子的电子排布图为: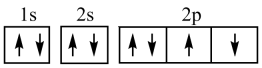


操作及现象 | 结论 | |
A | 在KSCN与 | 增大KCl浓度,平衡不移动 |
B | 将粗铜和精铜分别连接电源的正、负极,两电极减少和增加的质量不相等 | 质量变化大的电极一定与电源的负极相连 |
C | 常温下,用pH计分别测定饱和NaX溶液、饱和NaY溶液的pH: | 常温下酸性: |
D | 工业合成氨选择在500℃进行 | 升高温度原料的转化率增大 |






①压强、
、
由小到大的顺序是
②℃,若向该容器中充入3.0molNO和3.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,
, 则N点的
③体系总压强(P)与时间(t)的关系如图乙中曲线I所示:曲线II为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同,曲线II所对应的改变的条件可能为


甲池工作时,转变成绿色硝化剂Y,Y是
, 可循环使用。则石墨I是电池的极:石墨I附近发生的电极反应式为

乙中A极析出的气体在标准状况下的体积为


已知金属离子开始沉淀时pH和完全沉淀时pH如表所示:
金属离子 | ||||
0.1mol/L的金属离子,开始沉淀时pH | 6.3 | 1.5 | 3.4 | 5.8 |
完全沉淀时 | 8.3 | 2.8 | 4.7 | 7.8 |
回答下列问题:
滴定序号 | 待测液体积/mL |
|
|
1 | 25.00 | 0.03 | 22.03 |
2 | 25.00 | 0.09 | 22.07 |
3 | 25.00 | 0.10 | 22.12 |
滴定时选用滴定管(填酸式或碱式)产品纯度为(用质量分数表示,列出计算式即可)下列操作使产品纯度偏低的是
A.用蒸馏水洗净酸式滴定管后,装入标准进行滴定
B.用蒸馏水洗净锥形瓶后,再用待测溶液润洗
C.滴定达终点时,发现滴定管尖嘴部分有悬滴
D.滴定到终点读数时,俯视滴定管的刻度
E.用标准滴定结束时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
元素 | Mn | Fe | |
电离能/ | 717 | 759 | |
1509 | 1561 | ||
3248 | 2957 | ||
请写出基态的价电子排布式:,比较两元素的
、
可知,气态
再失去1个电子比气态
再失去1个电子难,请你从原子结构的角度解释