
选项 | 实验操作及现象 | 实验结论 |
A | 某溶液做焰色试验,若火焰颜色为黄色 | 该溶液中一定不含钾元素 |
B | 向某溶液中逐滴加入氢氧化钠溶液至过量,先无现象后产生白色沉淀,最后白色沉淀部分溶解 | 该溶液中可能含有Al3+ |
C | 向某溶液中滴入氯水无现象,再滴入KSCN溶液后溶液变红 | 该溶液中一定含有Fe2+ |
D | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中 一定含有SO |
①合金的硬度一般比它的成分金属的硬度都大
②合金的熔点一般比它的成分金属的熔点都低
③改变原料的配比、变更制造合金的工艺,可得到不同性能的合金
④氢氧化亚铁在空气中加热可以得到氧化亚铁
⑤在制备氢氧化亚铁时需要将胶头滴管插入到液面以下
⑥合金的应用范围比纯金属更广
|
|
|
|
|
| A.验证干燥的氯气没有漂白性 |
B.不能较长时间观察到Fe(OH)2白色絮状沉淀 |
C.证明氧化性: Cl2>Br2>I2 |
D.选择合适的药品,可用于制备少量的Cl2、O2等气体 |
① | ||||||||
② | ③ | ④ | ⑤ | |||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
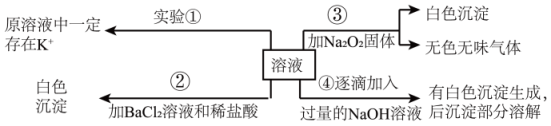
请你根据上述实验推断:

请回答下列问题:


b点时固体物质的化学式是。

①甲同学发现固体仍为黑色,由此判断:固体中肯定不存在Fe2O3 , 理由是。
②乙同学发现固体能全部被磁铁吸引,即做出了猜想:
猜想I:全是Fe;
猜想II:全是Fe3O4;
猜想III:;
实验小组同学准确称取10g固体于试管中进行实验,加入过量溶液,出现红色固体,且有黑色固体残留,猜想成立。将上述实验后试管内的剩余物过滤、洗涤、干燥,称得固体质量为10.4g,则铁与水蒸气反应后玻璃管内固体中Fe3O4的质量分数为。