A | B | C | D |
|
|
|
|
漂白粉 | 酒精 | 双氧水 | 浓硫酸 |



离子 | H+ | K+ | X | MnO | SO |
浓度(mol•L-1) | 0.4 | 0.2 | 0.1 | 0.4 | 0.2 |

选项 | 实验操作 | 实验现象 | 实验结论 |
A | 用蘸有浓硫酸的玻璃棒在白纸上写字 | 一段时间后字变黑 | 浓H2SO4有吸水性 |
B | 将SO2通入到H2S溶液中 | 产生淡黄色沉淀 | SO2有氧化性 |
C | 将银白色的金属钠放置在空气中 | 钠表面很快变暗 | 金属钠具有强还原性 |
D | 将Cl2通入到放有鲜花的试剂瓶中 | 鲜花褪色 | Cl2有漂白性 |

A.撤去酒精灯 B.上移铜丝,使其脱离浓硫酸 C.拔掉橡胶塞倒出浓硫酸
加入试剂 | 现象 | 结论 | |
第一份 | 加入NaOH溶液 | 有白色沉淀生成 | 沉淀为(写化学式) |
第二份 | 加入H2O2溶液 | 有白色沉淀生成 | 沉淀为(写化学式) |

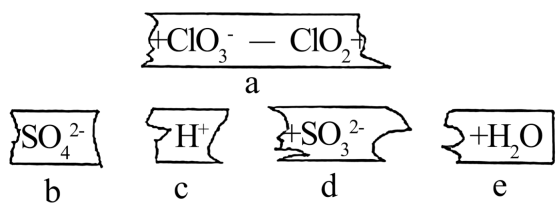
I-+H++H2O2=I2+H2O

请用化学用语回答下列问题: