 紫砂壶
C .
紫砂壶
C .  高压锅
高压锅
| 食物 | 苹果 | 柑桔 | 牛奶 | 鸡蛋清 |
| pH | 2.9~3.3 | 5.0~5.7 | 6.3~6.6 | 7.6~8.0 |
 B .
B .  C .
C .  D .
D . 


|
| X | Y |
| A | CO | Ca(OH)2 |
| B | CO2 | NaOH |
| C | HCl | Ba(OH)2 |
| D | SO2 | NaOH |
 B .
B .  C .
C .  D .
D . 
|
溶液名称 |
白醋 |
稀盐酸 |
氯化钠溶液 |
蒸馏水 |
石灰水 |
氢氧化钾溶液 |
|
X汁液 |
红色 |
红色 |
紫色 |
紫色 |
绿色 |
绿色 |
物质的结构决定性质,性质反映结构,据此回答.


增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是。盐酸所属的物质类别是 ;(填“有机物”或“无机物”)下列物质能与盐酸反应的是:
A.铁锈 B.水垢 C.硝酸钾 D.苛性钠
在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是。
②下图表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):

![]() 代表;
代表;
![]() 代表。
代表。



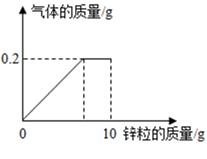
|
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
|
|
第1次 |
40 |
m |
|
第2次 |
40 |
14.8 |
|
第3次 |
40 |
12.2 |
|
第4次 |
40 |
11.2 |
|
第5次 |
40 |
11.2 |
试回答下列问题:

