A | B | C | D |
|
|
|
|
比亚迪公司采用的磷酸铁锂“刀片型”电池用于电动车驱动,它属于可充电电池 | 塑料在当今人类生产生活中不可或缺,它属于天然有机高分子材料 | “天宫空间站”的太阳能电池板主要材料是高纯度硅 | 氧化铝陶瓷可用于生产刚玉坩埚,它是两性金属氧化物 |


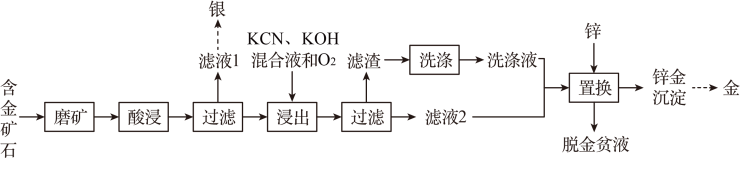
已知:
I.氢氰酸(HCN)易挥发、有剧毒,;
II.在碱性条件下易生成
沉淀
III. , 平衡常数
。
回答下列问题:
①其化学方程式为。
②已知 , 该反应的平衡常数
。

当“脱金贫液”初始pH>10时,的去除率下降的原因是。
A:
B:
C:
D:
①上述反应中属于吸热反应的是(填序号)。
②写出CO燃烧的热化学方程式。
已知每破坏1mol有关化学键需要的能量如下表:
H﹣H | N﹣H | N﹣N | N≡N |
435.9KJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=。
①400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得、
、
的物质的量分别为2mol、1mol、2mol,则此时反应v正(
)v逆(
)(填“>”、“<”或“=”)。
②若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡移动(填“向左”、“向右”或“不”)
①图1中投料比相同,温度从高到低的顺序为。
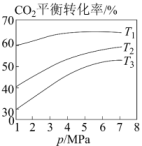
②图2中、
、
从大到小的顺序为。


定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论。有同学提出将0.1mol/L , 改为0.1mol/L,更为合理,其理由是;

甲图中,t1到t2速率明显加快的主要原因是
实验序号 | 反应温度/℃ |
| 稀硫酸 | |||
V/mL | c(mol/L) | V/mL | c(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | 0.10 | 0.50 | |||
③ | 20 | 0.10 | 4.0 | 0.50 | ||
该实验①、②可探究对反应速率的影响。实验①、③可探究硫酸浓度对反应速率的影响,因此。
①的电离度(用百分比表示)。
②该溶液中由水电离出的浓度是
。
③计算的电离平衡常数
。
化学式 | HClO | |
电离平衡常数( |
|
①向NaClO溶液通入少量的离子方程式。
②向的溶液中通入少量
的离子方程式。
③NaClO溶液的漂白性与溶液中c(HClO)有关。向NaClO溶液中加入下列物质,能增大c(HClO)的是 (填字母)。向新制的氯水中滴加2滴石蕊溶液,观察的现象为。
a. b.
c.
d.NaOH