

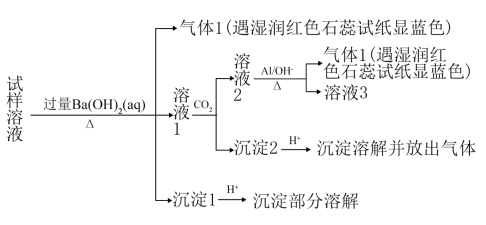
已知:3NO+8Al+5OH-+2H2O
+3NH3↑+8AlO
根据以上的实验操作与现象,该同学得出的结论错误的是( )
 B .
B . 
C .
C .  D .
D . 
 )常用作漂白剂,其分子中只含极性键
C . 铜凿剪纸是在铜箔上用小钢凿敲凿出图案,铜、铁都属于金属材料
D . 植物纤维是造纸的原材料之一,也是人体需要的六大营养物质之一
)常用作漂白剂,其分子中只含极性键
C . 铜凿剪纸是在铜箔上用小钢凿敲凿出图案,铜、铁都属于金属材料
D . 植物纤维是造纸的原材料之一,也是人体需要的六大营养物质之一
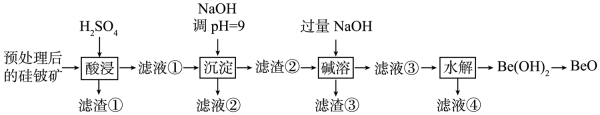
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO。下列说法错误的是( )
盐酸 分子式: 相对分子质量:36.5 密度:
|
①该学生需要量取 上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填A表示“偏高”、填B表示“偏低”、填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。
Ⅲ.定容摇匀后,发现液面低于刻度线。
Ⅳ.定容时,俯视读数,所得溶液的浓度。
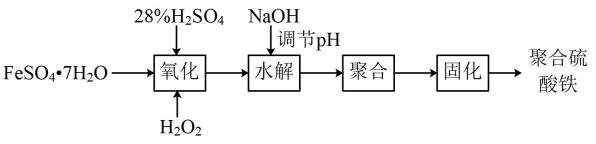
回答下列问题:
①生成沉淀A的离子方程式为。
②操作Ⅰ的名称为,固体C的化学式为。
③聚合硫酸铁中n(Fe3+):n(OH-):n(SO)。

已知:①常温下,Ksp[Fe(OH)3]=1.0×10-38 , Ksp(ZnS)=3.0×10-25 , Ksp(CuS)=6.0×10-36;
②BaS微溶于水,溶于水缓慢反应生成Ba(OH)2和H2S。
回答下列问题: