 B .
B .  C .
C .  D .
D . 

 B . 读取液体体积
B . 读取液体体积 C . 滴加液体
C . 滴加液体 D . 熄灭酒精灯
D . 熄灭酒精灯
 B .
B .  C .
C .  D .
D . 
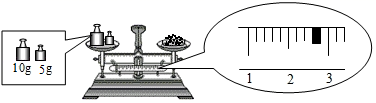
①试管②烧杯③试管夹④酒精灯⑤蒸发皿⑥石棉网⑦铁架台(带铁圈)⑧玻璃棒
A 新材料的研制 B “神十一”飞天轨道的设定
C 新药品的合成 D 新能源的开发和利用
①镁条燃烧时,化学能转化为能和能。最能说明镁条燃烧是化学变化的现象是(用字母序号表示,下同)。烟花、照明弹中用到镁粉作燃料,其原因是镁条燃烧时。
A 发出耀眼白光 B 放出大量热 C 生成白色固体
②举出一个储存能量的化学变化的例子。

①世界万物都是由及其微小的粒子构成。如水由构成,一个水分了由构成。
②科学家已经通过扫描隧道显微镜观测到原子和分子,而且实现了对原子和分子的移动和,以及复制、改造和创造分子。


①在该变化中,保持不变的粒子有(填选项序号);
A.氢原子 B.氢分子 C.氧原子 D.氧分子
②从图2能获取的一条信息是。

即使艳阳高照、天气晴好,有时人们也会出现眼睛刺痛、咳嗽等不良症状。专家认为,这很可能与臭氧(O3)有关。
臭氧原本是大气中自然产生的一种具有特殊臭味的微量气体。在常温常压下可缓慢反应生成氧气,当温度达到165℃迅速反应。绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层。臭氧量往往随纬度、季节和天气等因素的变化而不同。研究人员发现,天空中的臭氧层能吸收99%以上的太阳紫外线,为地球上的生物提供了天然的保护屏障。为何它又成了危害健康的污染物?
地表臭氧并非自然产生的,而是由石油产品(如汽油)等矿物燃料燃烧产生的氮氧化物(如二氧化氮)与空气中的氧气结合而形成的。强烈的阳光照射会加速这一化学反应。
地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过每立方米180微克的环境中,会产生上述不良症状。研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%。对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。
自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物。下图为某地夏季某日昼时(7:00~18:00)臭氧、二氧化氮(NO2)浓度随时间的变化图。

依据文章内容,回答下列问题。
A .8:00~10:00
B. 10:00~12:00
C. 12:00~14:00
D. 14:00~16:00
A 氧气和臭氧化学性质不同的原因是因为分子构成不同
B 臭氧层具有吸收紫外线的作用
C 地表空气中臭氧的含量与天气阴晴无关
D 空气中臭氧浓度不同会对人体造成不同程度的影响

①从物质分类的角度看,天然水属于。我们学过的混合物分离的方法有“过滤、蒸发、蒸馏、吸附”等。图1的净化装置中,小卵石和石英砂应用的混合物分离方法是,在实验室中,进行该操作所需要的玻璃仪器有。
②在图2的实验中,将天然水转化成蒸馏水采取的分离混合物的方法是,依据的原理是,区分海水和蒸馏水的方法是。试管a中注入天然水的量应不超过试管容积的,加热时,应用酒精灯的(填“外焰”“内焰”或“焰心”)。
③黄河是我们的母亲河,化学学习小组的同学们经过调查和搜集资料得知,可以通过①化学沉降法(加明矾);②消毒杀菌(用漂白粉);③自然沉降;④过滤等几个步骤对黄河水进行净化,请选择合理的操作顺序
A.①③②④ B.①③④② C.③④①② D.③①④②
①其中属于水的物理性质的有;属于水的化学性质的有;属于水的用途的有。(填字母)
②根据上文描述中水的化学性质,写出发生的化学变化的文字表达式并注明基本反应类型:。(写一项即可)

①从微观的角度分析,图3实验中发生变化的是;图4实验中发生的变化是。
②图4实验中,一段时间后试管b中得到的物质是(填化学符号),检验该物质的方法是,正负极气体的体积比是。

【查阅资料】
①面食的疏松多孔主要是因为制作过程中产生了气体;
②小苏打的主要成分是碳酸氢钠,通常是白色粉末状晶体,能溶于水,受热易分解。
③碳酸钙不溶于水,与小苏打不反应,900°c以上可以分解。
以上信息属于小苏打物理性质的是。
①;
②泡打粉在受热时能产生气体使面团膨胀松软。
小明取少量泡打粉于试管中,加入适量水,观察无气体产生,从而否定了猜想①。
小聪为探究猜想②设计了如图2所示的实验装置。该装置实验前应首先检查,小聪取一定量小苏打计入试管中,加热,观察到a试管口有水珠,b试管中澄清石灰水变浑浊,试管中剩余的固体经验证为碳酸钠,请写出该反应的文字表达式。