

A | B | C | D |
|
|
|
|
升高温度,平衡常数减小 | 0~3s内,反应速率为v(NO2)=0.2mol•L-1 | t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) |
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
选项 | 实验事实 | 结论 |
A | Na2S2O3溶液与稀硫酸反应,其他条件相同时,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
B | 向0.1mol·L−1的HCOOH中加水稀释,溶液pH增大 | HCOOH是弱酸 |
C | 向盛有2mL浓度为0.1mol·L−1的AgNO3溶液中滴加2滴0.1mol·L−1NaCl溶液,然后再滴加4滴0.1mol·L−1NaI溶液,白色沉淀转化为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向NaAlO2溶液中滴加NaHCO3溶液,产生白色沉淀 |
|
【注】滴定过程中,当滴入标准溶液的物质的量与待测组分的物质的量恰好符合化学反应式所表示的计量关系时,称反应达到了化学计量点,简称计量点。

已知:①C(s)+O2(g)=CO(g) ΔH1=-110.5kJ·mol−1;
②H2(g)+O2(g)=H2O(g) ΔH2=-241.8kJ·mol−1;
③C(s)+O2(g)=CO2(g) ΔH3=-393.5kJ·mol−1;
化学键 | H-H | O=O |
键能/kJ·mol−1 | 436.0 | 498.0 |
则断裂O—H的键能为kJ·mol−1。
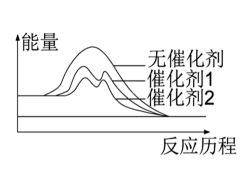
当反应进行相同的时间时(未达平衡),测得催化剂(填“1”或“2”)条件下CO转化率更高,其原因是。
 )是常用的基准物质,某学生用KHC8H4O4测定未知NaOH溶液的浓度。
)是常用的基准物质,某学生用KHC8H4O4测定未知NaOH溶液的浓度。
已知:①KHC8H4O4的相对分子质量为204.0;
②常温时,0.05mol/LKHC8H4O4溶液的pH约为4.0;
③在本实验中达到滴定终点时,溶液的pH约为9.1。
滴定管在使用前需要、洗涤、润洗;在规格为50.00mL的滴定管中,若NaOH溶液的起始读数为14.00mL,此时滴定管中NaOH溶液的实际体积(填序号)
A.14.00mL B.小于14.00mL C.36.00mL D.大于36.00mL
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
20.02 |
|
2 |
20.60 |
|
3 |
19.98 |



①;
②。