①反应NH3(g)+HCl(g) ═ NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ═ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l) ═ Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) ═ 2CO(g)不能自发进行,则该反应的ΔH>0

选项 | 操作 | 现象 | 结论 |
A | 用pH试纸分别测量NaNO2和CH3COONa溶液的pH | NaNO2溶液的pH约为8,CH3COONa溶液的pH约为9 | Ka(HNO2)>Ka(CH3COOH) |
B | 用pH试纸测量0.1mol·L-1NaHSO3溶液的pH | pH约为5 | 溶液中HSO |
C | 向滴有酚酞的氨水中加入CH3COONH4固体 | 溶液的红色变浅 | CH3COONH4溶液呈酸性 |
D | 室温下,向密闭容器中充入NO2 , 达平衡后,再慢慢扩大容器体积 | 最终容器中气体颜色比初次平衡时浅 | 2NO2(g) |




实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
则中和反应生成的
(保留1位小数)
若计算结果与理论数据()相比较,有误差,则可能导致该误差的原因是。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定溶液的温度
若改用盐酸和
溶液进行反应,与上述实验相比,所求中和热(填“相等”或“不相等”)。

相关金属离子生成氢氧化物沉淀的(金属离子的起始浓度为
)如下表:
氢氧化物 | ||||
开始沉淀的 | 1.5 | 6.5 | 7.2 | 8.0 |
沉淀完全的 | 3.2 | 9.9 | 9.5 | 11.1 |


①b点溶液中n():n(
)=。
②常温下, ,
。0.1 mol/L的(NH4)2SO3溶液中离子浓度由大到小的顺序为(不考虑OH-)。
③尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是。向浓度均为0.1 mol/L的CdCl2和ZnCl2混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中c(Zn2+):c(Cd2+)=。[已知 ,
]
④用草酸晶体(H2C2O4·2H2O),(已知草酸溶液 ,
)标准液滴定NaOH溶液浓度的步骤如下:准确称取草酸晶体m g置于锥形瓶中,加入新制蒸馏水25.00 mL,加入两滴酚酞溶液,用待标定的NaOH溶液滴定至终点(pH约为8.3),消耗NaOH溶液的体积为V mL。滴定终点的现象为,NaOH溶液的浓度为mol/L。
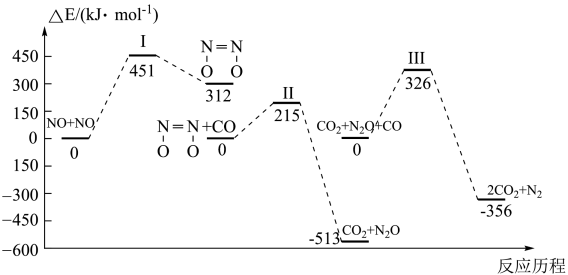
①
②
则;已知反应①的
,
(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则
(填“增大”、“不变”或“减小”)

①T2温度时便用催化剂Ⅰ,能否便转化率高于a%(填“能”或“不能”)
②催化剂Ⅱ条件下,当温度低于T6℃时,转化率随温度升高而升高的原因可能是。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

阴极电极反应式为,该装置中使用的是(填“阴”或“阳”)离子交换膜。