①金刚石、氢氧化铁胶体、豆浆均为混合物;
②HClO、CH3COOH、H2CO3均为酸;
③NaOH、NH4HCO3、KMnO4均为电解质;
④Na2O2、Na2O、MgO均为碱性氧化物;
⑤碳纤维、金刚石、石墨、C60互为同素异形体。
选项 | M | N | 电子转移 |
A | H2 | Cl2 |
|
B | Fe | CuCl2 | |
C | Al | H2SO4(稀) | |
D | Cl2 | H2O |
| 选项 | 实验目的 | 实验方案 |
| A | 确认Fe(OH)3胶体是否制备成功 | 用可见光束照射 |
| B | 确认金属活泼性:Na>Cu | 将金属钠投入CuSO4溶液中 |
| C | 确认钠与水反应生成NaOH | 向反应后的混合液中滴加酚酞 |
| D | 确认Cl2无漂白作用 | 将有色纸条放入干燥Cl2中 |



①为了完成实验,还缺少的玻璃仪器是。
②在操作步骤“转移”中,玻璃棒的作用是。
a.转移时有少量溶液洒出
b.转移后未用蒸馏水洗涤烧杯
c.定容时俯视刻度线
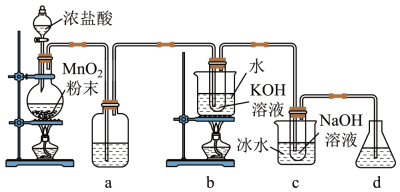
回答下列问题:
H2O+
NaCl
Cl2↑+
NaOH+
a.食物的腐败 b.钢铁的锈蚀 c.钟乳石的形成 d.Fe(OH)3胶体的制备
①选择两种属于不同基本反应类型的方法制取FeSO4 , 用离子方程式表示该方法:。
②依据“性质决定用途”的学科观念,分析K2FeO4的性质,预测K2FeO4在处理含NH的废水中的作用。简述分析过程:。
a.氧化物 b.酸 c.碱 d.盐
【实验1】加热碳酸氢钠固体,装置如图所示。

①利用上述装置可实现NaHCO3 , 向Na2CO3发生转化,试管中发生反应的化学方程式为。
【实验2】分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如表:
实验内容 | 实验现象 |
实验2-1 | 溶液浅红色褪去,立即产生大量气泡。 |
实验2-2 | 开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。 |
②实验2-1中,反应的离子方程式是。
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是。
④通过上述实验,从物质组成上分析Na2CO3 , 转化为NaHCO3 , 加入盐酸的作用是。
资料i:
物质 | NaCl | NaHCO3 | NH4HCO3 | NH4Cl |
20℃时的溶解度(g/100gH2O) | 36.0 | 9.6 | 21.7 | 37.2 |
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3•H2O),一水合氨属于一种碱。
向饱和NaCl溶液中通入足量CO2 , 无NaHCO3生成,原因是。
②向饱和NaCl溶液中先通入NH3 , 再通入CO2 , 在溶液中可析出NaHCO3晶体,该反应的化学方程式。