①增大反应物的浓度②升高温度③增大压强④加入催化剂

 B .
B .  C .
C .  D .
D . 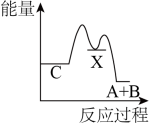
时间/min | 20 | 40 | 60 | 80 |
| 1.0 | 1.6 | 2.0 | 2.0 |

 B .
B .  C .
C .  D .
D . 

| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |


a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁,将剩余的稀盐酸转移至内筒中,以免造成测量误差
c.用量筒量取稀酸或稀碱时,视线必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1mol时所测得的中和反应的反应热(
)无影响

【实验II】另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液,均未观察到有明显的气泡产生。
实验I的目的是。
有同学建议将CuSO4改为CuCl2溶液,理由是;还有同学认为即使改用了CuCl2溶液,仍不严谨,建议补做对比实验:向2mL5%的H2O2溶液中滴入的试剂及其用量是。
资料1:KI在该反应中的作用:H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是。
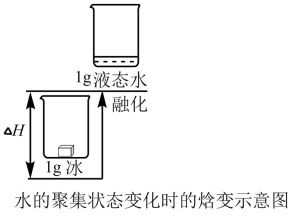
资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2+I-=H2O+IO-是放热反应
试写出表示氨气的燃烧热的热化学方程式:。

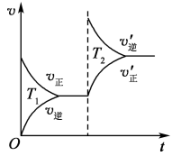
①若用的浓度变化表示反应速率,则A点的逆反应速率(填“>”“<”或“=”) B点的正反应速率。
②下列叙述中不能说明该反成达到平衡状态的是(填选项字母)。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.的消耗速率和
的消耗速率之比为2:1
D.固体质量不再发生变化
③工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有(填选项字母)。
A.升高温度 B.充入氮气 C.将尿素及时分离出去 D.增大反应体系的压强

根据以上反应机理,的过程中,断裂的是(填“极性键”或“非极性键”,下同),形成的是。与传统生产工艺相比,这种新方法的优点是(答出一点即可)。
反应I:;
反应II:。
为分析某催化剂对该反成的选择性,在1L密闭容器中充入1mol和2mol
, 测得有关物质的量关系如下图:

该催化剂在高温时选择反应(填“I”或“II”)。
催化加氢制甲醇是极具前景的资源化研究领域,主要反成有:
i.
ii.
iii.

①图甲中X代表(填化学式)。
②250℃时反应ⅱ的K1(填“>”“<”或“=”)。
③下列措施中,一定无法提高甲醇产率的是(填字母)。
A.加入适量CO B.增加 C.循环利用原料气 D.升高温度


已知:的选择率
随着温度的升高,的平衡转化率增加但甲醇的选择率降低,请分析其原因:。