①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
选项 | 混合物 | 碱 | 酸 | 碱性氧化物 | 酸性氧化物 |
A | 氨水 | 烧碱 | HNO3 | CaO | CO2 |
B | 空气 | 纯碱 | H2SO4 | MgO | P2O5 |
C | 胆矾 | 熟石灰 | NaHSO4 | Na2O2 | SO2 |
D | 液氯 | 氢氧化铁 | HclO | K2O | CO |
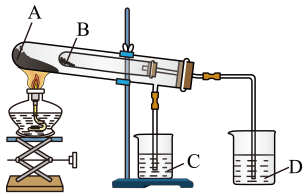
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
根据上述实验现象,下列说法错误的是( )
84消毒液①和医用酒精②是人们生活中常用的消毒剂,84消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。它可用③与
溶液④反应制得,其主要成分为
⑤、
⑥,是无色或淡黄色液体,人们主要利用84消毒液中
的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。
在上述短文标有序号的物质中,属于混合物的是(填序号,下同);属于电解质的是。用上述方法制备84消毒液时,发生反应的离子方程式为
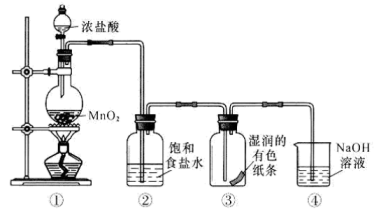
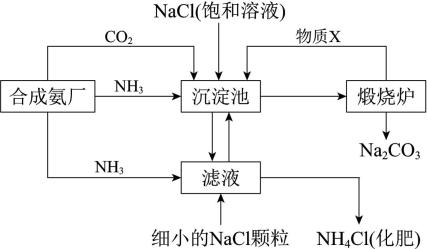
已知:i.NH3溶于水生成碱,与酸反应生成盐,如NH3+HNO3=NH4NO3
ⅱ.有关物质的溶解度如下表:
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20℃溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
回答下列问题:
①加入稀盐酸
②配制稀盐酸和
氢氧化钠溶液
③取一粒药片(药片质量相同,均为),研碎后加入
蒸馏水
④以酚酞为指示剂,用溶液中和过量的稀盐酸,记录所消耗
溶液的体积V
请回答下列问题:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
11.90 | 12.10 | 12.00 | 12.00 |
根据这位同学的实验数据,操作④中和的过量稀盐酸中的物质的量为,由此计算出药片中碳酸钙的质量分数为。