


① , 平衡后气体中
的物质的量分数为0.0250。
② , 平衡后气体中
的物质的量分数为0.0192。
在密闭容器中将等物质的量的和
混合,采用适当的催化剂进行水煤气变换反应,下列说法正确的是( )


已知一:甲槽电解的是一定浓度的
与
的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中
的物质的量浓度为
。
已知二:若乙槽为溶液,通电一段时间后,向所得的乙槽溶液中加入
的
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为(用
表示)。
已知三:若乙槽中溶液的溶质为和
, 且均为
。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则
、
、
氧化能力由大到小的顺序是。
萨巴蒂尔(Sabatier)反应可以将二氧化碳与氢气反应转化为甲烷和气态水,配合水的电解可以实现氧气的再生。
已知:ⅰ
ⅱ
ⅲ


A适当减压B.增大催化剂的比表面积C.反应器前段加热,后段冷却D.提高原料气中所占比例E。合理控制反应器中气体的流速
①已知、
的摩尔生成焓分别为
、
, Bosch反应的
(摩尔生成焓指一定条件下由对应单质生成
化合物时的反应热)。
②Bosch反应自发进行,低温更有利于平衡正向移动,但是Bosch反应必须在高温下才能启动,原因是。



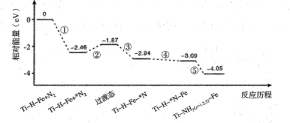
①图中、
、
由大到小的顺序为。
②在一定温度下,向的密闭容器中充入
和
, 经
达到平衡,此时
的转化率为50%。
内,
。平衡时
。

①A电极的电极反应式为。
②下列关于该电池的说法正确的是。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的不变
D.当有被处理时,转移电子物质的量为

写出负极电极反应式。若发电厂利用上述装置处理含废气,电池输出电压为
, 每天处理废气约为
(标准状况),废气中
体积分数为2.24%。则该电池每天提供
电能。(
的电量为
)

已知实验Ⅰ中和
的产物分别为
和
, 为了观察到明显的现象,初始时
至少为。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成对反应有催化作用
乙同学用如下实验证明假设2成立:
实验编号 | 室温下,试管中所加试剂及用量 | |||
|
|
| ||
a | 2.00 | 1.00 | 1.00 | 0 |
b | 2.00 | 1.00 | 0 | V |
则实验b中 , 若实验b中完全退色所需时间为
, 忽略混合前后体积的微小变化,用
的浓度变化表示的反应速率为
(保留2位有效数字)。
试管乙中的现象是,重新达到平衡时转化率(填“增大”、“减小”或“不变”)。向试管丙中加入
固体,平衡(填“正向”、“逆向”或“不”)移动。