
 B . 验证CO2的密度比空气的大
B . 验证CO2的密度比空气的大 C . 探究水的组成
C . 探究水的组成 D . 验证二氧化碳与水反应
D . 验证二氧化碳与水反应
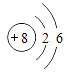 B .
B .  C .
C .  D .
D . 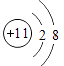
选项 | 实验目的 | 实验设计 |
A | 除去CO2中的CO | 将混合气体点燃 |
B | 测定某无色气体是否为CO2 | 取样滴加紫色石蕊溶液,观察溶液颜色变化 |
C | 区分两瓶无色液体氨水和石灰水 | 取样滴加无色酚酞溶液,观察溶液颜色变化 |
D | 探究燃烧的条件之一是需要可燃物 | 用棉花分别蘸酒精和水,放在酒精灯火焰上加热片刻,观察现象 |
 加热高锰酸钾和氯酸钾混合物制取氧气
B .
加热高锰酸钾和氯酸钾混合物制取氧气
B .  木炭在盛有足量氧气的密闭容器内充分燃烧
C .
木炭在盛有足量氧气的密闭容器内充分燃烧
C .  利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
D .
利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
D .  甲烷和过量的氧气在密闭容器中充分反应
甲烷和过量的氧气在密闭容器中充分反应

3 Li7 | 4 Be9 | 5 B11 | 6 Cl2 | 7 N14 | 8 O16 | 9 F19 | 10 Ne20 |
11 Na23 | 12 Mg24 | 13 Al27 | 14 Si28 | 15 P31 | 16 S32 | 17 Cl35.5 | 18 Ar40 |
试剂:稀盐酸、硫酸铜溶液、硫酸铝溶液、硝酸银溶液、铁粉、银丝、铝片、铜粉
实验步骤 | 实验现象 | 结论 |
铁的活动性比铝弱 | ||
铁的活动性比银强 |
由上述实验可得出金属活动性顺序为:Al>Fe>Ag。


①该方法制得O2的化学方程式是。
②可选用(填序号)装置组合。首先检查装置的气密性,方法是:把导管口放入水中,然后,观察到有气泡冒出,说明装置气密性良好。
③若要制取9.6克的氧气,则至少需要氯酸钾质量为克。
①实验室用锌与稀硫酸制取氢气并验证其可燃性,可选用(填序号)与E装置组合,在E导管口点燃。实验过程是:组装仪器→检查装置气密性→装入药品制备氢气→→点燃。
②电解水也可制得H2。装置如图F,管中产生的是氢气。
③氢气的生产方法是制约其作为清洁能源广泛使用的原因之一,科学家根据生产方法提出“绿色”氢气和“有污染”的氢气的概念,下列方法可获得“绿色”氢气的是。
A.用矿石生产锌和硫酸,再相互反应 B.在催化剂作用下,利用太阳能光解水
C.利用煤燃烧发电,再电解水 D.利用风能、水力发电,再电解水
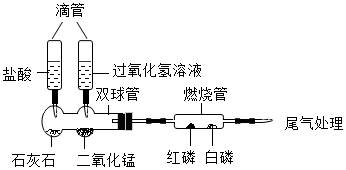
实验步骤如下:
挤压左滴管并微热燃烧管,白磷、红磷均不燃烧。
挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧。由该步现象说明燃烧需要的条件之一为。写出该步骤中双球管内发生的反应方程式。
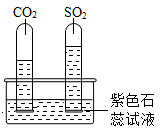
水槽中滴入紫色石蕊试液,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,试管内紫色石蕊试液都变成色;从实验还可得出结论:相同条件下的溶解性:SO2(填“>”或“<”)CO2。
收集一塑料瓶氧气进行以下三步实验:
①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下、三步实验中确保塑料瓶外形不变,
实验测得氧气的体积分数随时间变化的曲线依次为下图中的MN段、NP段和PQ段。

最能够说明氧分子不断运动的曲线是____。
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | KClO3 | 580℃ |
② | KClO3、MnO2(质量比1:1) | 350℃ |
③ | KClO3、CuO(质量比l:1) | 370℃ |
④ | KClO3、Fe2O3(质量比1:1) | 390℃ |
【分析数据、得出结论】
二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 |
据如表可知二氧化锰与氯酸钾的质量比为时,反应速率最快。