
选项 | 操作与现象 | 结论 |
A | 在Cu和稀硫酸中滴加 |
|
B | 电解含 | 氧化性: |
C | 在 | |
D | 测定浓度相同的 |

取足量于烧杯中,加入适量盐酸,充分反应,碳酸钡过量。过滤,得滤液M。
常温下,滤液M的pH7(填“>”“<”或“=”)。
方案1 重量法。取wg样品溶于蒸馏水,滴加足量的溶液和盐酸,过滤洗涤、干燥,得到固体质量为mg。
方案2 滴定法。实验步骤如下:
步骤1:取xg样品配成250mL溶液;准确量取25.00mL配制的溶液于锥形瓶;
步骤2:向锥形瓶中加入溶液(过量)使
完全沉淀;
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入指示剂溶液,用
溶液滴定过量的
至终点,消耗
溶液体积为
。已知:常温下,
,
。
方案1中,测定产品纯度为。如果用滤纸包裹在电炉中烘干,因温度过高,导致炭黑将部分
还原成BaS,则测得结果(填“偏高”“偏低”或“无影响”)。

①交换膜类型是。
②负极反应式为。
③标准状况下,参与电极反应,理论上转移mol电子。
A.混合气体密度不再随时间变化时达到平衡状态
B.增大硫单质的质量,逆反应速率会增大
C.达到平衡后,适当升温,的平衡转化率减小
D.平衡后充入少量惰性气体(不反应),平衡向左移动
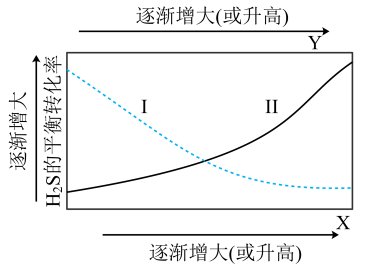
①代表的平衡转化率随温度变化的曲线为。
②解释曲线Ⅱ变化趋势:。