选项 | 强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 |
A | Ca(OH)2 | 乙醇 | N2O3 | Na2O |
B | CaSO4 | HClO | Mn2O7 | CaO |
C | NaHCO3 | 氨水 | SO2 | Al2O3 |
D | HCl | HF | CO2 | Na2O2 |



|
选项 |
试剂1 |
试剂2 |
试剂3 |
实验目的 |
|
A |
浓盐酸 |
MnO2 |
饱和食盐水 |
制备氯气 |
|
B |
盐酸 |
Na2CO3 |
Na2SiO3溶液 |
验证碳的非金属性比硅强 |
|
C |
盐酸 |
Na2SO3 |
品红试液 |
验证SO2具有漂白性 |
|
D |
稀硫酸 |
溶液X |
澄清石灰水 |
验证X溶液中是否有CO32- |




①制取氨气:打开装置导管上的旋塞,加热。
②制备NaNH2:加热装置中的金属钠,使其熔化并充分反应后,再停止加热装置
并关闭旋塞。
③制取NaN3:向装置中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却后,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,____,晾干。
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II. NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
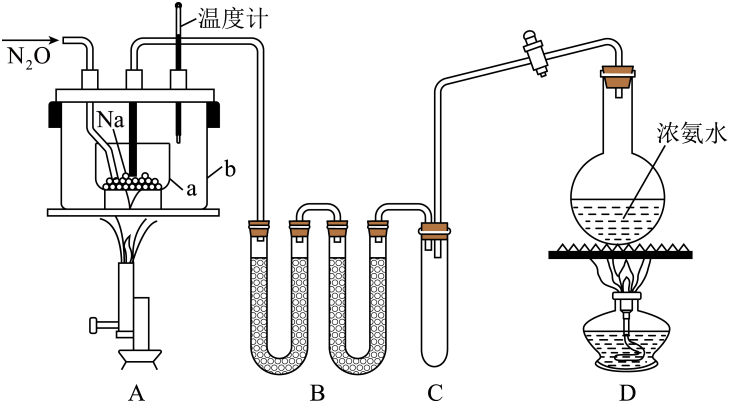

①仪器F的名称为;其中反应的离子方程式为。
②管q的作用为。
③若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VmL·mol-1 , 则产品中NaN3的质量分数为。

①为达到反应所需温度,需向原料气中掺入水蒸气,则K(主反应)(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是。

①104Pa时,图中表示丙烯的曲线是(填“i”、“ii”、“iii”或“iv”)。
②在恒温恒压条件下,下列叙述能说明主反应达到化学平衡状态的是
A.H2的生成速率等于C3H6的消耗速率
B.H2和C3H6的体积分数相等
C.混合气体的密度不再改变

已知:CO和H2的燃烧热分别为ΔH=-283.0kJ·mol−1、ΔH=-285.8 kJ·mol−1。
①图中催化剂为。
②298K时,该工艺总反应的热化学方程式为。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是。