| 物 质 | X | Y | Z |
| 初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
| 2 min末浓度/(mol·L-1) | 0.08 | a | b |
| 平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )

| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
已知:K300℃>K350℃ , 则该反应是热反应。

a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
a.准时分别出NO2气体 b.适当上升温度 c.增大O2的浓度 d.选择高效催化剂
(A)移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
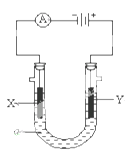
① Y电极上的电极反应式为
② 电解池中X极上的电极反应式为。在X 极附近观察到的现象是。
① X电极的材料是,电极反应式是。
② Y电极的材料是, 电极反应式是。(说明:杂质发生的电极反应不必写出)