选项 | 现象或事实 | 解释 |
A | Na和TiCl4在高温下反应制备Ti | Na具有强还原性 |
B | Fe3O4可用于制备印刷货币票面文字的防伪油墨 | Fe3O4具有磁性 |
C | 《天工开物》载有“凡石灰,经火焚炼为用” | “石灰”指的是CaCO3 |
D | 小苏打常作为烘焙糕点的膨松剂 | 小苏打指的是Na2CO3 |

 B . CH4、C2H5OH均属于非电解质
C . 用双线桥法表示电子转移的方向和数目:
B . CH4、C2H5OH均属于非电解质
C . 用双线桥法表示电子转移的方向和数目: D . 金属钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑
D . 金属钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑
选项 | 物质X | 物质Y | 物质Z |
|
A | Na2O | NaHCO3 | Na2CO3 | |
B | CO2 | C | CO | |
C | Fe | FeCl2 | FeCl3 | |
T | Ca(ClO)2 | HClO | HCl |

选项 | A | B | C | D |
实验操作 |
|
|
|
|
分析或结论 | 新制氯水中含有Cl2 , 光照时,Cl2逸出 | 氯水中含有的HClO与NaHCO3反应产生CO2 | 该实验说明新制氯水中含有HCl和HClO | 溶液颜色变为黄色,说明亚铁离子完全被氧化 |

下列说法正确的有____(填字母)。
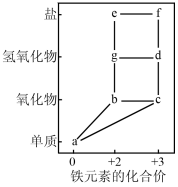
①写出g→d的化学方程式:。
②根据上述“价一类”二维图信息,下列说法正确的是(填字母)。
A.d胶体可用于饮用水消毒和净化
B.a转化为c只需控制纯氧的量即可实现
C.a→b→c→d之间的转化均可以通过一步反应实现
D.将a加入f的溶液中,溶液质量增加
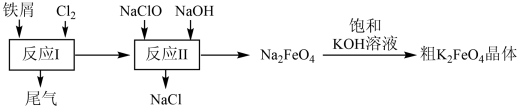
写出反应II的离子方程式:。
①上述反应的化学方程式为,其中盐酸表现出的性质是。
②有同学猜测铁与氯气反应可能还会生成氯化亚铁(假设铁已完全反应),该同学根据能否使酸性高锰酸钾溶液褪色来检验生成物中是否含氯化亚铁,你认为该同学的依据能否达到目的,并说明理由:。
③将8.7gMnO2与100g36.5%的盐酸充分反应后,再向溶液中加入足量的AgNO3溶液。若不考虑盐酸的挥发和氯气的溶解,则上述可制得的氯气是g,会得到g白色沉淀。


i.取一定质量的样品加水溶解后与如图所示的硫酸VmL恰好反应。
ii.将i中产生的气体用浓硫酸干燥后缓慢地通入足量的Na2O2粉末中充分反应,Na2O2粉末增重mg

①图中硫酸的物质的量浓度是。
②标准状况下i中产生气体的体积为L(用含m的代数式表示)。样品中小苏打的物质的量是mol(用含m、V的代数式表示)。