 B . 景泰蓝(铜-釉)
B . 景泰蓝(铜-釉) C . 沙金戒指(铜-金)
C . 沙金戒指(铜-金) D . 手镯(金-玉石)
D . 手镯(金-玉石)

选项 | 劳动项目 | 化学知识 |
A | 自主探究:以草木灰为原料制钾盐 | 钾盐水解呈碱性 |
B | 家务劳动:用白醋清洗水壶中的水垢 | 乙酸属于有机物 |
C | 学工活动:用生石灰富集海水中的 |
|
D | 社区服务:社区人民给铁护栏粉刷油漆 | 电化学保护法防止铁腐蚀 |


实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量溶液,产生黑色沉淀
下列有关说法正确的是

②下列操作可能使测定结果偏低的是。
a 滴定前平视读数,滴定终点时仰视读数 b 装碘标准液的滴定管用蒸馏水洗净后未润洗
c 滴定尖嘴部分,滴定前有气泡,滴定后无气泡 d 滴定过程中锥形瓶内溶液洒出锥形瓶

①反应在前50s的平均速率。
②反应达到平衡后,升高温度,则(填“增大”“减小”或“不变”),再次达到平衡后,
的平衡浓度为
, 则反应的
(填“>”“=”或“<”)0。

①为获得尽可能纯的 , pH应控制在。
②25℃时,的电离常数为
,
,
, 则
时,溶液中
。

1molH2S(g)全部氧化为(aq)的热化学方程式为。
①
②
③
写出乙烷(C2H6)标准摩尔生成焓的焓变=(用含
、
、
的式子表示)。


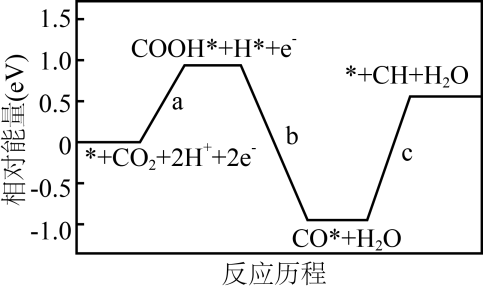
通入CO2气体的一极为(填“阴极”、“阳极”、“正极”或“负极”),写出该极的电极反应式:,若电解时电路中转移0.4mol电子,则理论上生成NaClO的物质的量为mol。

下列说法正确的是
a.实验开始时,电子由经盐桥流向
b.图2中,b点时反应达到化学平衡状态
c.向左边烧杯中加入盐酸后,平衡逆向移动
d.若将所加的盐酸换成氢氧化钠溶液,平衡逆向移动,电流增大