 B . 称量氢氧化钠
B . 称量氢氧化钠 C . 吸取药液
C . 吸取药液 D . 测定溶液pH
D . 测定溶液pH
 粗盐称量
B .
粗盐称量
B .  租盐溶解
C .
租盐溶解
C .  浊液过滤
D .
浊液过滤
D .  蒸发结晶
蒸发结晶

①合金中至少含有两种金属
②合金一定是混合物
③合金中的元素以化合物的形式存在
④合金一般比组成它们的纯金属硬度更高,熔点更低
⑤合金中各成分保持自己原有的化学性质
实验顺序 | 实验内容 | 实验现象 |
① | 甲+乙 | 有气泡产生 |
② | 甲+丙 | 有沉淀产生 |
③ | 丙+丁 | 有沉淀产生 |
④ | 乙+丙 | 无明显现象发生 |

选项 | 物质(括号内为杂质) | 除去杂质的方法 |
A | K2SO4溶液(KCl) | 加入适量的硝酸银溶液,过滤 |
B | CaO(CaCO3) | 加水溶解、过滤 |
C | CO2(CO) | 点燃混合气体 |
D | KCl固体(K2CO3) | 先加水溶解,再加稍过量的稀盐酸,蒸发结晶 |
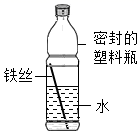
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀最严重
③铁锈的主要成分是四氧化三铁
④一段时间后,塑料瓶可能会变瘪


a.甲烷 b.熟石灰 c.干冰 d.活性炭



请根据上述除杂方案,回答下列问题:
![]()
【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
Ⅱ.NaHCO3的水溶液呈碱性.
Ⅲ.室温(20℃)时,四种物质的溶解度数据如下:
物质 | NaHCO3 | NaCl | NaOH | Na2CO3 |
溶解度g/100g水 | 9.6 | 36 | 109 | 215 |
【资料分析】
依据上述资料分析该瓶试剂不可能是碳酸氢钠的原因是 .
实验1:实验测得该溶液的pH>7,则这瓶试剂也不可能是 .
实验2:为了检验该溶液是什么溶液,又进行了如下实验:
取少量溶液于试管中,滴加足量的盐酸,有气泡产生,得出结论,该溶液是Na2CO3溶液.写出上述反应的化学方程式: .有同学对上述结论提出质疑,他认为该溶液可能由 组成,并设计如下实验.
实验3:另取样,加入过量的CaCl2溶液(呈中性),观察到有白色沉淀产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入酚酞试液,溶液呈红色;得出结论,该同学的假设成立.
上述实验中,证明所加氯化钙溶液是过量的方法是 .
