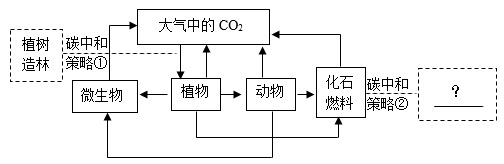
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使燃着的蜡烛熄灭的气体,后来被证实是CO2。
资料二:1754年,布莱克将石灰石锻烧首次制得CO2 , 并完成了如下所示的物质转化研究。

资料三:1766年,卡文迪许通过实验测得,室温下1体积水大约能溶解1体积二氧化碳气体。

探究Ⅰ.影响因素探究
在制取CO2气体时,为了探究影响反应快慢的因素,小组同学进行了四组实验,如表所示
|
实验组别 |
甲 |
乙 |
丙 |
丁 |
|
大理石的质量/g、颗粒大小 |
m块状 |
m块状 |
m粉末状 |
m粉末状 |
|
盐酸的体积/mL、浓度 |
V稀盐酸 |
V浓盐酸 |
V稀盐酸 |
V浓盐酸 |
若探究盐酸的浓度对上述反应的影响,可选择实验甲与(选填实验组别)进行对照。

做CO2与NaOH溶液发生反应的验证实验时,同学们将NaOH溶液加入到充满CO2气体且质地较软的塑料瓶中,观察到塑料瓶变扁,由此得到CO2与NaOH发生反应的结论。但有同学认为上述现象产生的原因还可能是CO2气体溶于水导致气压减小。
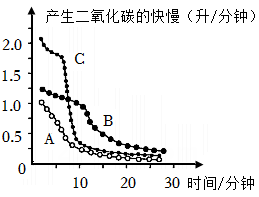
为回答该同学的质疑,小科进行了如下实验:在两个250mL的烧瓶中分别充满CO2气体,通过注射器同时向两个烧瓶中分别注入同体积的水和NaOH溶液,最后得到烧瓶内压强与时间的关系曲线(如图2所示)。由此,小科得出CO2气体溶于水会导致塑料瓶变扁,同时CO2与NaOH也发生了化学反应的结论。
结合图2中A、B曲线变化特点,写出能证明CO2与NaOH发生了化学反应的证据。
小组同学在实验室中组装了相应的实验装置(如图3)。小科利用该实验装置按如下步骤进行实验:

①先通一段时间的空气
②称量D装置的质量为m1
③打开分液漏斗的活塞,将稀盐酸全部加入锥形瓶,待充分反应后,关闭活塞
④再次通空气一段时间
⑤再次称量D装置的质量为m2
有同学指出实验步骤③操作明显不合理,你认为该同学的理由是。

实验一:将6个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图乙),分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如表。
容器编号 | 1 | 2 | 3 | 4 | 5 | 6 |
平均时间/秒s | 3.2 | 3.8 | 5.0 | 7.1 | 11.1 | 19.0 |
实验二;将3支温度计分别挂在小玻璃罩内不同位置(如图丙),点燃蜡烛,一段时间后发现温度计①示数明显增大,温度计②③示数增大不明显。
17世纪初,海尔蒙特发现木炭燃烧后不但有灰烬,还产生了一种不可见的气体,于是他将该气体命名为“森林之精”。蜡烛的火焰会在该气体中熄灭,说明了这种气体的化学性质有。
实验室常用石灰石和稀盐酸反应制取二氧化碳。现要制取4.4克二氧化碳,至少需要含碳酸钙质量分数为80%的石灰石多少克?
人类降低空气中的二氧化碳含量的研究有两个方向:一是减少二氧化碳的排放,二是增加二氧化碳的消耗。请写出一条你能做到的消耗二氧化碳的方式或途径:。
盐酸利用率与盐酸溶质质量分数的关系
|
组别 |
A |
B |
C |
|
盐酸溶质质量分数 |
7.3% |
14.6% |
21.9% |
|
盐酸利用率 |
82.5% |
81.5% |
72.1% |
Ⅰ.碳减排:减少人类生产和生活中二氧化碳的排放量。
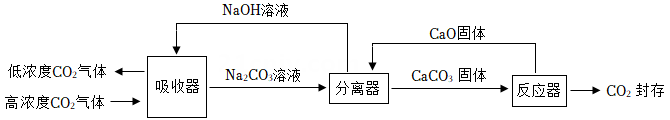
用该技术进行“碳捕获"有效利用了原材料,该过程中被循环利用的物质有。
Ⅲ.碳转化:指二氧化碳的资源化利用。
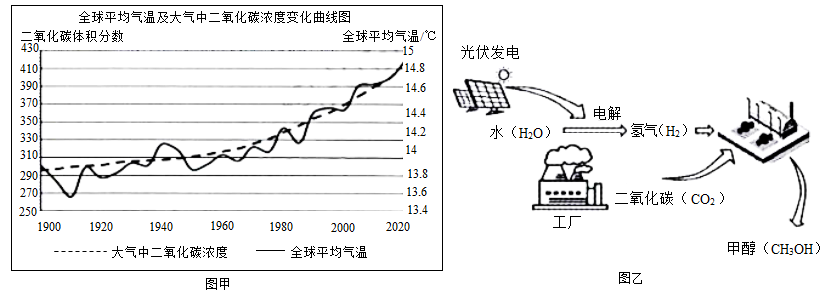
①浙江大学研发的“二氧化碳烟气微藻减排技术”,利用微型藻类吸收二氧化碳实现固碳。微型藻类是(选填“真核”或“原核”)生物,该技术的本质是利用微藻的作用实现固碳。
②固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于变化(选填“物理”或“化学”)。
③我国研发的“液态太阳燃料合成技术”(乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇制取过程中能量转化是太阳能→电能→ 能。
甲醇合成时,若碳元素全部来自于二氧化碳,则制取10吨甲醇需要消耗二氧化碳 吨。
(二氧化碳转化成甲醇的方程式为:CO2+3H2 CH3OH+H2O)

①与燃油汽车相比,纯电动汽车每行驶100km会向空气减少排放kg的二氧化碳。
(ρ汽油=0.7×103kg/m3 , 结果精确到0.1)
②从获取电能的各种方式看,相对于燃煤发电,符合“减碳”理念的是发电。