
在湿法炼锌的电解循环溶液中,较高浓度的Cl﹣会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4 , 生成CuCl沉淀从而除去Cl﹣ . 根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )

选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
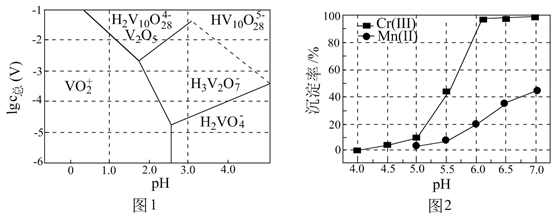
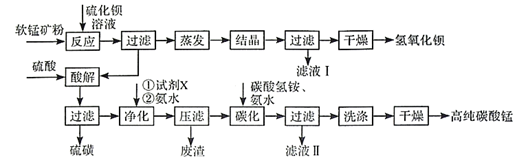
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | | | | |
回答下列问题

合成反应:
滴定反应:
已知: 易溶于水,难溶于乙醇,
开始失结晶水。
实验步骤:
Ⅰ. 制备:装置A制备的
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
约为7时,停止通入
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到 产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用 产品配制的溶液滴定碘标准溶液至滴定终点,计算
含量。
请回答:
A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的 溶液作洗涤剂
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→()→()→()→()→()→开始滴定。
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是。
③滴定法测得产品中 含量为
,则
产品中可能混有的物质是。
①生成FeCO3沉淀的离子方程式为。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。