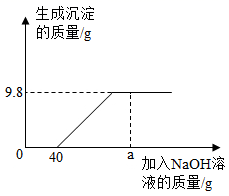
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200mL量筒量取所需水的体积
④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶
⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小。

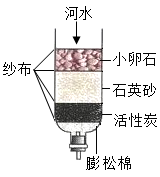 可用自制简易净水器制纯净水
B .
可用自制简易净水器制纯净水
B .  充有氧气的气球不会一直停留在烧杯底部(气球本身质量忽略)
C .
充有氧气的气球不会一直停留在烧杯底部(气球本身质量忽略)
C . 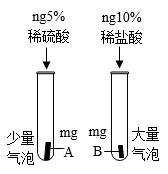 若A、B金属的表面积相同,则金属活动性由强到弱的顺序:B>A
D .
若A、B金属的表面积相同,则金属活动性由强到弱的顺序:B>A
D .  锌粒与稀盐酸混合反应后,天平指针向左偏转
锌粒与稀盐酸混合反应后,天平指针向左偏转
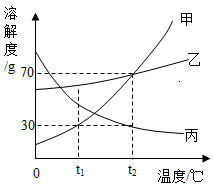
 等质量的锌粉和镁粉分别与足量的等质量分数的稀盐酸反应
B .
等质量的锌粉和镁粉分别与足量的等质量分数的稀盐酸反应
B .  向在空气中久置已部分变质的氢氧化钠溶液中滴加稀盐酸至过量
C .
向在空气中久置已部分变质的氢氧化钠溶液中滴加稀盐酸至过量
C .  氢氧化钠溶液中加水稀释
D .
氢氧化钠溶液中加水稀释
D .  某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
选项 | 物质 | 杂质 | 除杂质方案 |
A | O2 | N2 | 将气体通过足量灼热的铜粉 |
B | NaNO3溶液 | Na2SO4 | 加入过量的Ba(NO3)2溶液,过滤 |
C | FeCl2溶液 | HCl | 加入过量铁粉,过滤 |
D | NaCl固体 | CaCO3 | 加入足量水溶解,过滤,蒸发结晶,干燥 |

①植树造林 ②用新能源汽车代替燃油汽车 ③发展核能产业,利用核能发电 ④开发利用氢能 ⑤推广使用无铅汽油

已知:。不考虑金、银发生类似反应。
①将电路板粉碎成粉末的目的是。
②步骤二中的实验现象是。
③步骤四中反应的化学方程式为:。
④步骤一所得的溶液中含有的阳离子有:(填离子符号)。为了更好的实现金属资源的回收,某同学向该溶液中加入了一定量的镁粉并等待其充分反应后过滤得到了滤渣和滤液,观察到滤液呈无色,滤渣中可能含有(填化学式,下同),滤液中可能含。

步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的(填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是。
A.①Na2CO3②Ca(OH)2 B.①Ca(OH)2 ②Na2CO3
C.①KOH ②Na2CO3 D.①NaOH ②Na2CO3

①仪器A中所发生反应的化学方程式为。
②装置F的作用是。
③仪器D的玻璃管中放入的塑料试样碎屑质量为5.6g,它充分燃烧后,测得仪器E2质量增加7.2g,则5.6g该塑料试样中含碳元素的质量为g。

操作Ⅰ的名称是。
步骤一:

步骤二:
取混合物D中的上层清液少许,滴加酚酞溶液,溶液变红。
混合物D中有白色沉淀,则原废弃物中有,发生反应的化学方程式是。
小鹏对实验二进行了反思,原废弃物中还有物质不能确认是否存在。为了确认其是否存在,且不影响其他物质的检验,需要对步骤一中某一种试剂的使用做出如下修改:。
【查阅资料】
①脱氧剂成分是铁粉、碳粉、碳酸钠、氯化钠;
②食品干燥剂的成分是生石灰。
探究活动一:脱氧剂脱氧原理
①取适量脱氧剂于大试管中,加足量的水振荡,充分溶解后过滤,得到滤液A和滤渣甲;
②向滤渣甲中加入足量稀盐酸,观察到有气泡产生,得到黄色溶液,溶液底部有黑色不溶物。
【得出结论】脱氧剂脱氧的原理是铁粉与发生了化学反应,生成铁锈。
【进行实验】
①取一包干燥剂放入小烧杯中,加入适量的水,充分搅拌后,用手触摸烧杯外壁,发烫,过滤,得到滤液B和滤渣乙;
②向滤渣乙中加入足量的稀盐酸,可观察到固体全部溶解,有气泡产生,据此判断滤渣乙中有。
【得出结论】该干燥剂(选填“完全”或“部分”或“没有”)变质。
小组同学将上述实验中的滤液A和滤液B倒入废液缸中,观察到有白色沉淀生成,过滤后得到滤液C,他们对C中溶质的成分进行了探究。
【提出猜想】
猜想一:
精想二:NaCl、NaOH、Na2CO3
猜想三:NaCl、NaOH、Ca(OH)2
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液C于试管中,加入足量的氯化钡溶液 | 无明显现象 | 猜想不正确 |
②继续向步骤①所得溶液中通入二氧化碳 | 有白色沉淀生成 | 猜想三正确 |
小组同学经过讨论,一致认为根据步骤②的现象不足以证明猜想三是正确的,理由是。
小明经过认真思考后,对步骤②进行了修改,并做了下面的实验,最终得出了正确的结论,记录如下。请你完善实验报告。
实验步骤 | 实验现象 | 实验结论 |
有白色沉淀生成 | 猜想三正确 |