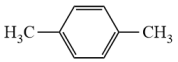
 等
B . 液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C . 煤炭的清洁化利用:煤炭→
等
B . 液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C . 煤炭的清洁化利用:煤炭→a.(观察气泡产生的快慢)
b.(观察浑浊产生的快慢)
反应 | 影响因素 | 所用试剂 | |
A | a | 接触面积 | 块状CaCO3、0.5 mol/L HCl 粉末状CaCO3、0.5 mol/L HCl |
B | a | H+浓度 | 块状CaCO3、0.5 mol/L HCl 块状CaCO3、3.0 mol/LHCl |
C | b | H+浓度 | 0.1 mol/L Na2S2O3、稀H2SO4 0.1mol/L Na2S2O3、浓H2SO4 |
D | b | 温度 | 0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、冷水 0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、热水 |
实验 | 实验现象 | |
ⅰ | 将铜粉加入试管中,再加入稀 | 溶液变蓝,液面上方呈浅红棕色;至不再产生气泡时,铜粉有剩余,余液呈酸性 |
ⅱ | 继续向ⅰ中试管加入少量固体 | 又产生气泡,铜粉减少,液面上方呈浅红棕色 |
ⅲ | 取饱和 | 无明显变化 |
下列说法错误的是( )
①单独制备:
, 不能自发进行
②单独脱除:
, 能自发进行
协同转化装置如图(在电场作用下,双极膜中间层的解离为
和
, 并向两极迁移)。下列分析错误的是

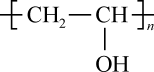
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。
①乙醚的沸点低于乙醇,原因是。
②用乙醚提取效果更好,原因是。
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中C、H、O的原子核附近电子云密度大小:。
②图中晶胞的棱长分别为a、b
、c
, 晶体的密度为
。(用
表示阿伏加德罗常数;
;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
一定条件下,用将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为。
②的空间结构为。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。

①;
②。
①不同条件下,达到相同的平衡转化率,温度越高,所需的压强越大,
0。
②一定压强下,与
的投料比[
]对体系中
平衡转化率的影响如下:

时,解释
平衡转化率随投料比增大而降低的原因:。
①ⅰ.
ⅱ.。
②反应结束后,分离混合物[硫酸(含、
)、S(吸附了
)等],从中获得固体S以及
与
的混合液,便于循环利用。
a.该过程中,应选取的化学试剂是。
b.根据所选取的化学试剂,设计方案,得到S以及与
的混合液。实验方案是:。(用简要文字说明即可)
实验序号 | ⅰ | ⅱ |
所加试剂 |
|
|
| ≈50% | ≈100% |
分析ⅱ中的去除率提高的原因:
a.直接还原
了。
通过计算说明电子得、失数量关系:,证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生
(不导电),它覆盖在
表面,形成钝化层,阻碍电子传输。
c.能与
反应生成
。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为,
的去除率约为50%,证明该原因不合理。
步骤1.取v含氮(
)水样,加入催化剂、
标准溶液(过量),再加入稀
。
步骤2.用标准溶液滴定剩余的
(
被还原为
),终点时消耗
。
已知:
①水样中的含量为
。
②溶液中影响测定。向步骤1中加入适量
, 产生
驱赶
, 否则会使测定结果(填“偏大”或“偏小”)。
 ),Q再经下列过程合成褪黑激素。
),Q再经下列过程合成褪黑激素。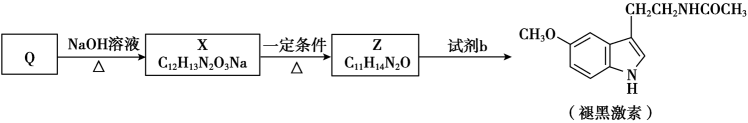
①X的结构简式是。
②Z的结构简式是。
③试剂b是。
 )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。 |
纳米金颗粒大小(nm) |
颜色 |
|
2~5 |
黄 |
|
10~20 |
红 |
|
30~80 |
紫 |
资料:的溶液呈黄色,其酸性比柠檬酸强。
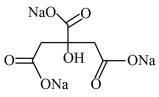
①在制备过程中,存在如下反应,已知产物是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
的结构简式) 。
□
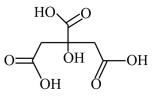 →□ +□ (
→□ +□ ()+□
+□HCl
②柠檬酸钠的作用是,如果一段时间后的液体仍为黄色,则可以(填操作)来检验是否生成纳米金。
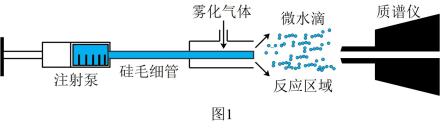
①使用丙酮酸(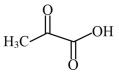 )来验证,通过检验由丙酮酸生成的产物,证明猜想成立。
)来验证,通过检验由丙酮酸生成的产物,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。
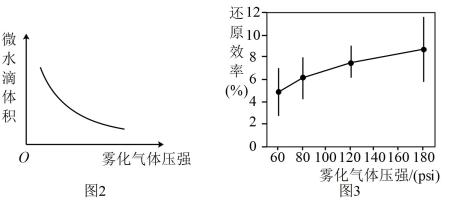
还原效率会随着雾化气体压强的增大而增大的原因是。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的与还原剂后会显示红色荧光,过程可以表示为:R(无色)
(红色荧光)。加入R后观测到的现象如图4所示。
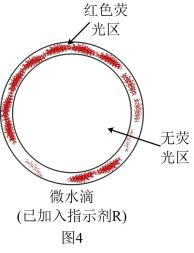
结合图4和上述实验,你可以得出什么推论?。