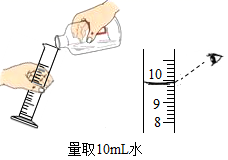
 B .
B .  C .
C .  D .
D . 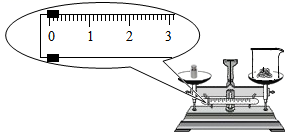
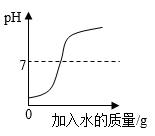 向一定量稀盐酸中加水稀释
B .
向一定量稀盐酸中加水稀释
B . 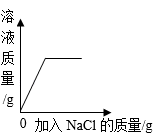 一定温度下,不饱和氯化钠溶液中加入氯化钠
C .
一定温度下,不饱和氯化钠溶液中加入氯化钠
C . 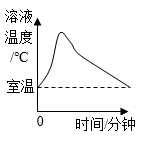 室温时,向一定量的稀盐酸中滴加氢氧化钠溶液
D .
室温时,向一定量的稀盐酸中滴加氢氧化钠溶液
D .  用等质量、等浓度的双氧水分别制取氧气
用等质量、等浓度的双氧水分别制取氧气
A.食盐 B.纯碱 C.硫酸铜 D.烧碱 E.熟石灰 F.稀硫酸 G.食醋
①CuSO4 溶液与 KOH 溶液混合:。
②HNO3 溶液与 NaHCO3 溶液混合:。
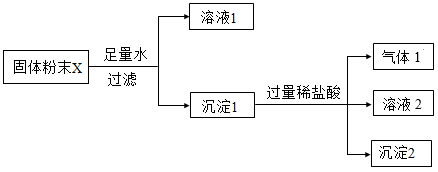
【查阅资料】①该工厂原材料有硫酸钠、碳酸钠、氢氧化钠、氯化钠等
②硫酸钠溶液呈中性
③BaSO4、AgCl均不溶于水,也不溶于酸
【提出问题】该工厂排放的废水的成分有几种?
【作出猜想】排放的污水含有硫酸钠、碳酸钠、氢氧化钠、氯化钠中的一种或几种
实验步骤 | 实验现象 | 分析与结论 |
①取少量污水,向其中滴入足量的。 | 有气泡产生 | 污水中一定含有。产生气泡发生反应的化学方程式为。 |
②取少量污水,向其中滴入过量的CaCl2溶液,振荡静置后,再滴入无色酚酞溶液溶液。 | 污水中含有NaOH。滴加过量的CaCl2溶液的目的是。 | |
③取少量污水,先滴加足量稀硝酸,再滴加BaCl2溶液。 | 开始有气泡生成后无明显现象 | 污水中一定不含有。 |
④向③反应后的溶液中滴入AgNO3溶液。 | 污水中一定含有NaCl |
【得出结论】小组同学经过实验探究出污水中所含物质的成分。
【做出猜想】小明根据所学酸碱盐知识做出以下猜想:
猜想一:可能含有CO ,
猜想二:可能含有,
猜想三:可能含有CO和OH-。
实验二:取少量粉末,滴加足量的稀盐酸,有无色无味气体产生。将生成气体通入澄清石灰水,观察到,证实洗涤剂中含有CO。
①该洗涤剂中含有Na2CO3、NaOH等;
②Na2CO3溶液显碱性。
【小结反思】实验二中产生气体的化学方程式为。
实验三中可选试剂:A BaCl2溶液
B Ba(OH)2溶液
C NaCl溶液
D 稀盐酸
E 石蕊溶液
F 酚酞溶液
实验三:取少量粉末,加水配成溶液,加入稍过量的(选填字母编号,下同),产生了白色沉淀,再加几滴,溶液变为红色,证实洗涤剂中还含有NaOH。
【实验结论】该洗涤剂中含有Na2CO3和NaOH。