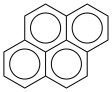
 )的一氯代物有5种
C . H2NCH2COOH与H2NCH2CH2COOH互为同系物
D .
)的一氯代物有5种
C . H2NCH2COOH与H2NCH2CH2COOH互为同系物
D .  中最多有13个碳原子共面
中最多有13个碳原子共面
A | B | C | D |
|
|
|
|
配制0.10mol·L-1NaCl溶液 | 制备并收集NH3 | 制备Fe(OH)3胶体 | 检查装置气密性 |



查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

II.“焙烧”过程中铁的氧化物未参与反应
III.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓)Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
IV.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:

反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=kJ·mol-1

①该反应在低温下是否可以自发进行(填“是”“否”或“无法确定”);
②下列能提高CO2平衡转化率的措施有;
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X2.0(填“>”“<”或“=”);
④若起始加入1molCO2和2molH2 , 则Q点的平衡常数K=;

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①催化剂助剂主要在起作用(填“第i步”或“第ii步”“第iii步”);
②在Fe3(CO)12/ZSM-5中添加助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因是。

已知:i.过氧乙酸为无色液体,易溶于水;极不稳定,遇高热会引起爆炸;氧化性与高锰酸钾相当。
ii.相关物质性质
相关物质 | CH3COOH | CH3COOOH | 乙酸丁酯 |
沸点(℃) | 118 | 105 | 126 |
实验步骤:
①向油水分离器中加入适量蒸馏水液面低于分水器支管口;
②仪器2中加入冰醋酸、固体酸催化剂和适量乙酸丁酯,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为55℃;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入浓度为35%的双氧水;
④当油水分离器中水层液面升高到支管口时,经过操作a后,打开活塞逐滴放出适量水……;
⑤待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。

化学键 | B-H | B-O | B-B |
键能(kJ·mol-1) | 389 | 561 | 293 |
晶体 | 金刚石 | 晶体硅 | 晶体硼 |
熔点(K) | 3832 | 1683 | 2573 |
沸点(K) | 5100 | 2628 | 3823 |
硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是。
②每一个硼基本单元由个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为;

 为原料合成
为原料合成 , 其合成路线为。
, 其合成路线为。