 倾倒液体
B .
倾倒液体
B .  塞紧橡胶塞
C .
塞紧橡胶塞
C .  熄灭酒精灯
D .
熄灭酒精灯
D .  稀释浓硫酸
稀释浓硫酸

| 选项 | 劳动项目 | 化学知识 |
| A | 用发酵粉培制糕点 | NaHCO3能产生CO2 |
| B | 用布擦干淋湿的自行车 | 铁部件潮湿易生锈 |
| C | 用食醋清除水壶内壁的水垢 | 醋酸能与水垢反应 |
| D | 利用活性炭自制简易净水器 | 活性炭具有还原性 |

| 选项 | 实验目的 | 实验方案 |
| A | 检验铵态氮肥 | 加熟石灰研磨,闻气味 |
| B | 鉴别CuO和C | 观察颜色 |
| C | 除去N2中混有的少量O2 | 通过灼热铜网 |
| D | 分离MnO2和KCl | 用水溶解、过滤、蒸发、烘干 |

 电解一定质量的水
B .
电解一定质量的水
B .  表示向等质量、等质量分数的稀硫酸中分别加入过量的锌粉和铁粉
C .
表示向等质量、等质量分数的稀硫酸中分别加入过量的锌粉和铁粉
C .  向一定质量的饱和氢氧化钙溶液中加入氧化钙
D .
向一定质量的饱和氢氧化钙溶液中加入氧化钙
D .  向一定质量的盐酸和氯化钙混合溶液中滴加碳酸钠溶液
向一定质量的盐酸和氯化钙混合溶液中滴加碳酸钠溶液
 探究铁生锈需要氧气
B .
探究铁生锈需要氧气
B .  探究CO2与NaOH能否发生反应
C .
探究CO2与NaOH能否发生反应
C .  探究可燃物燃烧需达到着火点
D .
探究可燃物燃烧需达到着火点
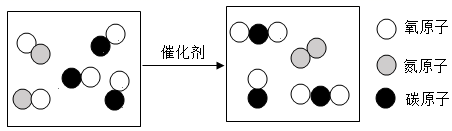
D .  验证质量守恒定律
验证质量守恒定律
A.熟石灰 B.洗洁精 C.食盐 D.干冰 E.盐酸
营养成分 | 水 | 糖类 | X | 脂肪 | 钾、钙、锌、铁 | 维生素 | …… |
质量 | 84.8g | 10.3g | 0.7g | 0.6g | 187.4mg | 62.2mg | …… |

①1000g“上等卤水”蒸干后,可得氯化钠的质量约为g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水100g、NaCl 39.8g、MgCl27.65g及其他成分2.55g。将150g此溶液降温至20℃,有g NaCl析出(溶解度见表)。此时,(填“有”或“没有”)MgCl2析出,原因是。
|
温度/℃ |
20 |
60 |
100 |
|
|
溶解度/g |
NaCl |
36.0 |
37.3 |
39.8 |
|
MgCl2 |
54.8 |
61.3 |
73.0 |
|
A 煤 B 地热能 C 太阳能 D 核能



a.收集气体前,集气瓶中没有注满水 b.导管口开始有气泡冒出,立刻收集
c.收集气体后,集气瓶中仍有少量水 d.收集气体后,集气瓶正放在桌面上
【提出问题】灰白色沉淀可能含有什么物质?
【查阅资料】①Mg(OH)2受热分解生成 MgO 和 H2O;
②变色硅胶遇水由蓝色变为粉红色;
③碱式氯化镁[化学式:Mg(OH)Cl]不溶于水,受热易分解生成 MgO 和HCl气体。
【提出假设】
甲同学认为灰白色沉淀中不含 MgCl2 , 你认为原因是:。
乙同学认为灰白色沉淀中可能含有:猜想Ⅰ:Mg 猜想Ⅱ:Mg(OH)Cl 猜想Ⅲ:Mg(OH)2
序号 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 向试管①中加入适量(填物质名称) | 沉淀消失无气泡产生 | 猜想I不成立 |
实验2 | 加热试管②,并将蘸有紫色石蕊溶液的滤纸条置于试管口 | 滤纸条变红 | 猜想Ⅱ |
实验3 | 加热试管③,将产生的气体通过变色硅胶 | 变色硅胶 | 猜想Ⅲ成立 |
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
|
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。