

实验操作和现象 | 实验结论 | |
A | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
B | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 | CF2Cl2是极性分子 |
C | 石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去 | 气体中含有乙烯 |
D | 用pH计分别测0.1molL-1NaClO和CH3COONa溶液的pH,前者pH大 | Ka(HClO)>Ka(CH3COOH) |
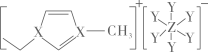


已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是



①中物质 | ②中物质 | 预期现象 | |
A | 乙醇 | 酸性KMnO4溶液 | 紫色溶液颜色变浅或退去 |
B | H2S溶液 | Na2SO3溶液 | 溶液变浑浊、产生气泡 |
C | H2O2溶液 | 淀粉KI溶液 | 溶液变蓝 |
D | 浓氨水 | AlCl3溶液 | 生成白色沉淀后又溶解 |

 +2H+
D . 合成1mol扑热息痛,理论上甲室质量增重64g
+2H+
D . 合成1mol扑热息痛,理论上甲室质量增重64g

难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
下列说法错误的是

①[Cu(NH3)4]2+的H—N—H键角(填“>”、“=”或“<”)NH3的H-N-H键角。
②若[Cu(NH3)4]2+中两个NH3分别被Cl-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2Cl2:

[Cu(NH3)4]2+的空间构型是;在水中的溶解度:(m)(n)(填“>”、“=”或“<”)。
③NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是。


已知:①N2H4是一种强还原剂,在碱性条件下可将多数金属离子还原成单质。
②Ksp(AgCl)=1.8×10-10 , NaCl在浓硫酸中难溶,Ag2SO4在不同浓度硫酸中的溶解量如下:
硫酸浓度/(mol•L-1) | 18 | 15 | 12 | 9 | 6 | 0 |
硫酸银溶解量/(g•L-1) | 209.00 | 78.94 | 31.20 | 11.14 | 8.74 | 4.68 |
回答下列问题:
将KClO3和KOH置于铁坩埚中加热熔融,分多次将MnO2粉末加入,强热5分钟。充分反应后冷却,将固体捣碎,加水溶解,微热,趁热减压过滤得到K2MnO4溶液。
反应的化学方程式为。
实验原理:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3
实验装置如图所示,将K2MnO4溶液转移到三颈烧瓶中,关闭旋塞2、5,打开旋塞1、3、4,趁热往K2MnO4溶液中通入CO2发生反应,没有反应的CO2被收集到气囊a中。

待气囊a收集到较多气体时,关闭旋塞1和旋塞,打开旋塞,轻轻挤压气囊a,将气体压入K2MnO4溶液中继续反应。未反应的CO2又被收集在气囊b中,如此反复直至K2MnO4完全歧化,经过一系列操作得到KMnO4晶体。整个过程中温度不宜过高的原因是。
准确称取2.00gKMnO4产品溶于水,配成100.00mL溶液。用移液管取25.00mL0.2mol·L-1的H2C2O4溶液于锥形瓶中,并加入2mL稀硫酸。用上述KMnO4溶液滴定H2C2O4溶液,重复操作3次,消耗KMnO4溶液的体积平均为20.00mL。
滴定终点的现象是,计算可得产品中KMnO4的纯度是,下列情况会导致KMnO4纯度测定值偏小的是(填标号)。
A.产品含少量K2MnO4 B.酸式滴定管滴定后有气泡
C.酸式滴定管没有润洗 D.滴定接近终点时用少量蒸馏水冲洗锥形瓶内壁
①含有酚羟基和氨基 ②苯环上有两个取代基 ③能发生水解反应
 的合成路线。
的合成路线。
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=kJ·mol-1 , 升高温度,(填“增大”或“减小”)。

②起始物=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=Pa,反应I以物质的量分数表示的平衡常数KxI=。


其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将(填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)(填“增大”、“减小”或“不变”),p(CO)(填“增大”、“减小”或“不变”)。