选项 | 操作和现象 | 结论 |
A | 常温下将打磨过的铝片放入浓硝酸,无明显现象 | 常温下铝与浓硝酸不反应 |
B | 将蘸取了某溶液的玻璃棒进行灼烧,火焰呈黄色 | 该溶液中含有钠元素 |
C | 用玻璃棒蘸取浓硫酸滴在纸上,纸变黑。 | 浓硫酸具有脱水性 |
D | 向淀粉溶液中加入稀H2SO4 , 加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解生成葡萄糖 |


![]()
“操作”是指;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的(填写仪器名称)。

a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤I:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤II:向步骤I所得的溶液中加入适量稀H2SO4溶液,用0.0020mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①步骤I加入过量铜粉的目的是。
②步骤II滴加KMnO4溶液时发生反应的离子方程式为。
③用KMnO4标准溶液滴定至终点的标志是。。
④黑木耳中铁的含量为mg/100g(即每100g黑木耳中含铁元素的质量)。
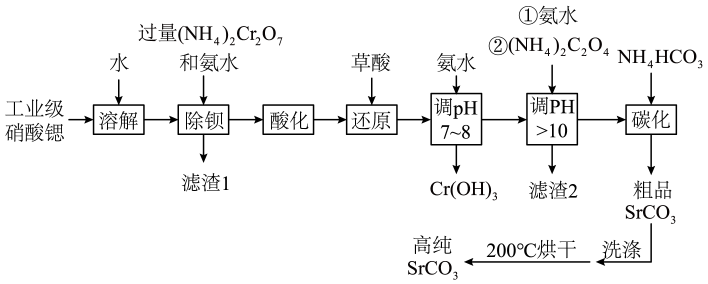
已知:①BaCrO4不溶于水,在水溶液中与Ba2+不能结合。
②在碱性条件下不能转化为Cr3+。
③常温下,各物质的溶度积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | SrCO3 |
Ksp近似值 | 4.6×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 5.6×10-10 |
回答下列问题:



①压强p1、p2、p3中,最大的是。
②p1=0.5MPa,A点的平衡转化率为,压强平衡常数Kp=。




![]()

已知:i. (R1、R2代表烃基)
(R1、R2代表烃基)
ii.
iii.
回答下列问题:
 对布洛芬进行成酯修饰的化学方程式为。
对布洛芬进行成酯修饰的化学方程式为。a.易溶于有机溶剂
b.能与碱或碱性物质反应
c.能与溴发生加成反应