选项 | 物质使用 | 解释 |
A |
|
|
B | 高纯硅用于光导纤维、太阳能电池、计算机芯片 | 硅具有半导体性能 |
C | 液晶可作电视显示屏 | 液晶分子可沿电场方向有序排列 |
D |
|
|

 C . 试剂b为
C . 试剂b为
选项 | 实验目的 | 实验操作 |
A | 测定 | 将固体溶于水配制成溶液,分别以酚酞和甲基橙为指示剂,用标准盐酸滴定 |
B | 比较HClO与 | 用pH计测量相同浓度NaClO溶液和 |
C | 提纯混有 | 将固体溶于水,蒸发浓缩,冷却结晶、过滤 |
D | 比较 | 向KBr、KI混合溶液中依次加入少量氯水和 |

已知:Mn(II)在酸性环境中较稳定,在碱性环境中易被氧化;在酸性溶液中钒通常以、
等存在;沉铬过程中,当溶液
时,开始出现沉淀,此时铬离子浓度为
。下列说法正确的是


①与Co同周期,基态原子有1个未成对电子的元素有种。
②配离子的空间构型为,钴元素价态为,通过整合作用形成的配位键有个。
③配合物A无顺磁性,则中心离子的杂化方式为(填标号)。(若中心离子具有单电子,则配合物为顺磁性物质。)
A. B.
C.
D.
④咪唑(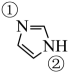 )具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
)具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
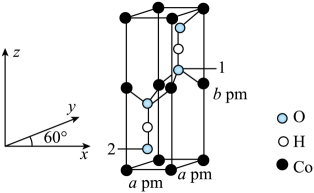
已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为。为阿伏加德罗常数的值,该晶体的密度为
(用计算式表示)。

已知:I.阴、阳离子交换树脂的基本工作原理分别为、
(
表示树脂的有机成分)。
II.“沉钯”时得到氯钯酸铵固体,不溶于冷水,可溶于稀盐酸。

A.硫酸 B.盐酸 C.无水乙醇


原理:
已知:气体有毒,遇水发生水解产生两种酸性气体
i.连接装置,检查装置气密性,装入药品并通;
ii.加热反应管至400℃;
iii.控制开关,加热 , 温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关、
的状态分别为。
②补全步骤v的操作:,其目的是。

已知:;
①绿色沉淀完全溶解后,继续加热一段时间再进行后续操作,目的是。
②样品中无水三氯化铬的质量分数为(结果保留三位有效数字)。
③若将碘量瓶换为锥形瓶,则样品中无水三氯化铬质量分数的测量结果(填“偏高”、“偏低”或“无影响”)。
I.具有两性 II.两分子X间可形成六元环
a.为平面型分子 b.可以发生水解反应 c.分子中含结构
 的合成路线。
的合成路线。

步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I |
| |||
II |
|
①则反应I与反应II的活化能:(填“>”“<”或“=”)。
反应的平衡常数
(用
、
、
、
表示)。
②在400k、初始压强为的恒温刚性容器中,按
通入NO和
, 一定条件下发生反应。达平衡时NO转化率为90%,
转化率为40%。则
的平衡常数
(分压=总压×物质的量分数;理想气体状态方程
,
)。

①5min内,温度从420K升高到580K,此时段内NO的平均反应速率(保留3位有效数字)。
②无氧条件下,NO生成的转化率较低,原因可能是。