选项 | A | B | C | D |
目的 | 配制100mL 0.1mol·L-1的硫酸 | 除去氯气中的HCl气体 | 由FeCl3溶液制取FeCl3固体 | 判断2NO2(g) |
实验 方案 |
|
|
|
|

已知:常温下,Fe(OH)2的Ksp=-8.1×10-16;强碱性溶液中Zn元素主要以的形式存在。


①滴定终点的现象为:。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量(填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为%。

已知:i.0.1mol·L-1金属离子形成氢氧化物沉淀与氢氧化物沉淀溶解的pH范围如下:
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Mg2+ | |||
开始沉淀的pH | 1.5 | 4.0 | 4.6 | 7.6 | 9.5 | |||
沉淀完全的pH | 2.8 | 5.2 | 6.8 | 9.7 | 11.1 | |||
金属氢氧化物 | Al(OH)3 | Cr(OH)3 | ||||||
开始溶解的pH | 7.8 | 12 | ||||||
溶解完全的pH | 10.8 | >14 | ||||||
ii.Cr(OH)3+OH-=+2H2O
iii.已知Cr的金属性强于Fe

①下列分步反应中,能垒最大的是(填标号)。
a.A→Bb.C→Dc.F→G
②A→B中,断裂共价键吸收的总能量催化剂吸附放出的总能量(填“大于”、“小于”或“等于”)。
③D→E的化学方程式为。

①容器I中为(填“绝热”或“恒温”)过程。判断的依据是。
②若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
③n点时反应的平衡常数Kp=中的(Kpa-1)。(提示:用分压计算的平衡常数为Kp , 分压=总压×物质的量分数)
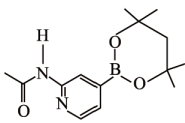
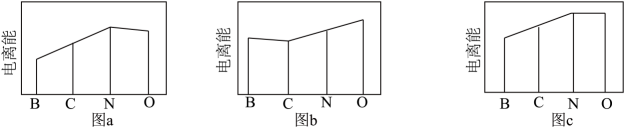
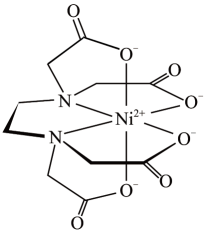
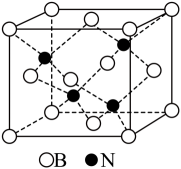
1个该配合物中通过螯合作用形成的配位键有个,在形成配位键前后C-N-C键角将(填“增大"“减少”或“不变”)。