 丝线织锦
B .
丝线织锦
B .  滴水成冰
C .
滴水成冰
C .  雕琢玉石
D .
雕琢玉石
D .  蜡烛燃烧
蜡烛燃烧
 点燃酒精灯
B .
点燃酒精灯
B .  稀释浓硫酸
C .
稀释浓硫酸
C . 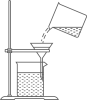 过滤
过滤

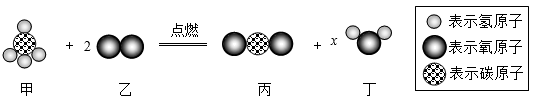
加入试剂 | 甲 | 乙 | 丙 |
实验现象 | 有气泡冒出 | 产生沉淀 | 无明显现象 |
选项 | 物质(杂质) | 除杂方案 |
A | 铜粉(氧化铜) | 在空气中充分灼烧 |
B | NaCl溶液(Na2CO3) | 加入适量稀硫酸 |
C | H2O(CO2) | 通过足量NaOH固体,干燥 |
D | CaCl2溶液(HCl) | 加入过量碳酸钙粉,过滤 |
①空气中含量最多的气体;
②一种可溶性的盐;
③一种可导致酸雨的氧化物;
④一种难溶性的碱。

①从物质分类的角度看,甲醇(CH3OH)属于(填“氧化物“无机物”“有机物”之一)。
②甲醇(CH3OH)中碳原子与氢原子的个数比(填最简整数比)。
③在淀粉[(C6H10O5)n]中,元素质量分数最高的是(填元素符号)。

①在乙炔(C2H2)气体中,碳、氢两种元素的质量比是(填最简整数比)。
②轨道施工过程中常用乙炔(C2H2)燃烧的火焰来焊接金属,乙炔在氧气中充分燃烧的化学方程式为。

①彩釉玻璃是将釉料粉刷到玻璃表面,然后经过加工处理得到的装饰性玻璃产品。玻璃属于材料(填“有机高分子”“金属”“无机非金属”之一)。
②国家能源集团为世界大学生夏季运动会提供碳核算服务,制定减排方案,下列不利于实现“碳中和”的措施是(填选项序号之一)。
A.植树造林,绿化环境 B.大量燃烧化石燃料
C.乘坐公共交通,低碳出行 D.推进能源体系清洁低碳发展

①太阳能电池板的主要材料高纯硅,可以利用石英砂(主要成分是SiO2)制得。在SiO2中硅元素的化合价为。
②三氟化氮在太阳能电池制造中有广泛应用。在铜的催化下,氟气(F2)和NH3反应得到三氟化氮(NF3)和氟化铵(NH4F),此反应的化学方程式:。

①t1℃时,NaCl的溶解度(选填“大于”“等于”“小于”之一) NH4Cl的溶解度。
②t2℃时,在50g水中加入25gNH4Cl,经充分溶解后,所得溶液中溶质与溶液的质量之比为(填最简整数比)。
③t1℃时,将不同质量的NH4Cl饱和溶液和NaCl饱和溶液均升温至t2℃时,NH4Cl溶液的溶质质量分数NaCl溶液的溶质质量分数(填写“大于”“等于”“小于“无法判断”之一)。
④t1℃时,如图所示,试管中盛有一定量NH4Cl的饱和溶液且试管底部有少量NH4Cl固体存在。现向试管外盛水的烧杯中加入一些NaOH固体后发现试管中的NH4Cl固体逐渐溶解,请简要解释出现此现象的原因:。


①所选仪器的符合题意连接顺序为(从左到右填写仪器序号)。
②实验室制取二氧化碳的化学方程式为。
③若将CO2通入澄清的石灰水中,石灰水的pH将(填“变大”“变小”“不变”之一),原因是。
①仪器A中所发生反应的化学方程式为。
②仪器E的玻璃管中放入的塑料试样质量为m克,塑料试样充分燃烧后,测得仪器B2质量增加3.6克,仪器D质量增加8.8克,则在该塑料试样中碳、氢元素的质量比为。
③若装置中没有连接仪器B1 , 这样测算出的该塑料试样中氢元素的质量与实际值比较将(填“偏小”“偏大”“基本一致”之一)。
①小明各取两种无色溶液少许,分别加入A、B两支试管中,用干燥的长塑料管分别向两试管中的溶液里慢慢吹气,观察到A试管中有白色浑浊现象,B试管中无明显现象。则可判断A试管中加入的是(填化学式)溶液。
②小红从下列四种试剂中选取了一种试剂,进行鉴别实验,根据明显现象也成功鉴别了上述两种无色溶液。则小红所选的这种试剂不能是下列中的(填选项序号中一项)。
A 无色酚酞试液 B.NaCl溶液 C.Na2CO3溶液 D.Fe片

试根据上述实验过程和发生的现象做出判断,填写以下空白:
①气体C的化学式是。
②滤液G中一定大量存在的阳离子是(填离子符号)
③写出步骤Ⅲ中生成沉淀H的化学方程式。
④混合物B中一定不存在的物质是,理由是。
⑤为了进一步确定该固体混合物A中到底是有KCl还是有KNO3 , 可另取固体混合物A样品再进行实验,请完成实验方案的设计(实验步骤、现象及结论):。


①当滴入上述稀盐酸至图中A点时,烧杯中溶液里的B溶质为(写化学式)。
②当滴入上述稀盐酸至图中B点时,试通过计算,求此时所得不饱和溶液中溶质的质量(计算结果精确至0.1g)。