 B . 测溶液的酸碱度
B . 测溶液的酸碱度 C . 过滤液体
C . 过滤液体 D . 称量固体
D . 称量固体
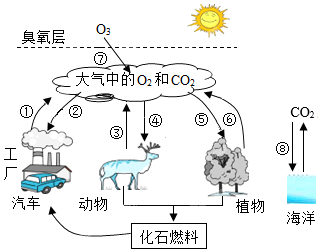
① ②3CO2 ③SO3 ④Fe3+ ⑤3He ⑥NH3 ⑦3

构成物质的微粒 |
|
|
|
|
|
反应前的质量/g | 68 | 32 | 0 | 1 | |
反应后的质量/g | 0 | 0 | X | 37 |
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 探究影响物质溶解性的因素 | 实验测定空气中氧气的含量 | 探究铁钉生锈时氧气是否参与反应 | 实验验证燃烧需要氧气 |
选项 | 实验目的 | 实验设计 |
A | 除去二氧化碳中的氯化氢气体 | 将气体通过饱和碳酸氢钠溶液,再通过浓硫酸 |
B | 检验碳酸钠溶液中是否含有氯化钠 | 加过量的稀盐酸后,再滴加硝酸银溶液 |
C | 除去MgCl2溶液中的少量MgSO4 | 加适量的BaCl2溶液,过滤 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |
 向两份完全相同的稀盐酸中分别加入过量的锌粉、镁粉
B .
向两份完全相同的稀盐酸中分别加入过量的锌粉、镁粉
B .  向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C .
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C .  向含有硫酸和硫酸铜的溶液中滴加NaOH溶液
D .
向含有硫酸和硫酸铜的溶液中滴加NaOH溶液
D .  向一定溶质质量分数的氢氧化钠溶液中不断加水
向一定溶质质量分数的氢氧化钠溶液中不断加水
①液氢和液氧可用于发射火箭的推进剂,其反应生成物无污染。写出氢气燃烧的化学方程式。
②神舟十六号载人飞船使用的是目前世界上最先进的砷化镓太阳能电池。砷(As)、镓的原子结构示意图和镓元素在元素周期表中的信息如图所示,下列说法正确的是。

A.砷和镓元素位于同一周期
B.砷化镓的化学式为Ga3As5
C.镓的相对原子质量为69.72g
D.铝原子的最外层电子数为3,铝能与盐酸反应,故镓也可能与盐酸反应
①《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明铜锡合金相较于铜、锡的特点是。
②向一定量的Al(NO3)3、AgNO3和Fe(NO3)2的混合溶液中加入ng锌,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的固体质量小于ng。滤液中(选填“一定有”、“一定没有”或“可能有”)AgNO3;将滤渣加入足量稀盐酸中,有气泡产生,写出产生气泡时一定发生的反应的化学方程式。


①从微观角度分析液态水与气态水的区别是。
②通过环控生保系统得到的饮用水为软水。生活中常用区分硬水和软水。
③早期空间站内二氧化碳可用超氧化钾(KO2)吸收,生成碳酸钾和氧气,该反应的化学方程式是。
①若甲物质中混有少量乙物质,最好采用(选填“降温结晶”或“蒸发结晶”)的方法提纯甲。
②t1℃时,甲、乙、丙三种物质的饱和溶液同时升温至t2℃,所得溶液中溶质质量分数由大到小的顺序为。

①图一中在集气瓶底部加入少量水的作用是。
②图二中可观察到干燥的紫色石蕊试纸不变色,湿润的紫色石蕊试纸变红,说明CO2具有的性质是。
③某同学用图三实验装置直接来验证质量守恒定律不成功,原因是。

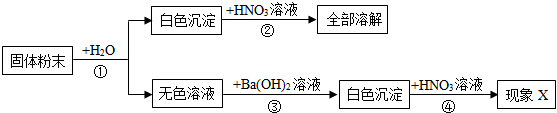
①试剂X为(填字母序号)。
A.NaOH B.KOH C.NaNO3
②滤渣中的物质为(填写物质化学式)。
③加适量盐酸的作用是为了除去(填写物质化学式)。

①通常状况下,NH3的溶解度远大于CO2的溶解度。为了提高产率,吸氨碳化塔中应该先通入的是(填“NH3”或“CO2”)。
②吸氨碳化塔中温度控制在30℃~35℃,发生反应的化学方程式为。
③该流程中能循环利用的物质是。(填化学式)


①X装置中应盛放的试剂是。
②硬质玻璃管中的现象为,该装置的不足之处是。

①实验A中,推入NaOH溶液后,可观察到的现象是。
实验结束后,小组同学对B试管中上层清液的溶质成分产生疑问,作出猜想;
猜想一:只含有NaOH
猜想二:含有NaOH,Na2CO3
猜想三:含有NaOH、Ca(OH)2
②同学取少量B试管中的清液分别置于甲、乙两支试管中,进行探究:
实验操作 | 实验现象 | 结论 |
在试管甲中滴加碳酸钠溶液 | 不产生白色沉淀 | 猜想三不正确 |
在试管乙中缓慢加足量稀盐酸 | 猜想二正确 |
烧杯A和烧杆B中分别盛有氢氧化钠溶液和氢氧化钡溶液,向烧杯A和烧杯B中分别加入硝酸铁溶液,出现的相同实验现象是都产生红褐色沉淀,从微观角度分析现象相同的原因是。
向烧杯B中滴加硫酸钾溶液,反应的微观示意图如上图所示,反应的化学方程式为,实验现象为;而向烧杯A中滴加硫酸钾溶液与烧杯B中现象不同,从微观角度分析原因是。
基于“结构决定性质”预测陌生物质的化学性质
烧杯C中盛有某溶液,请根据所含的微粒预测该溶液能与下列试剂发生化学反应的有____(填字母序号)。
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入碳酸钠溶液的质量/g | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
反应后溶液的总质量/g | 88.9 | M | 166.7 | 205.6 | 245.6 |
请根据实验数据分析解答下列问题: