选项 | 科技新闻 | 相关阐述 |
A | 以芝麻壳为原料,制备高性能超级电容器 | 芝麻壳的主要成分是油脂 |
B | 通过光热效应,将香蕉皮分解为多孔碳和氢气 | 天然生物质转化为新能源,实现废物利用 |
C | C60在一定条件下能转化为导电、高硬度的非晶态碳玻璃 | 碳玻璃与C60互为同素异形体 |
D | 用紫外线作能源、氯化铝作催化剂,将废弃聚苯乙烯塑料转化为更有价值的产品 | 聚苯乙烯的链节为 |
选项 | 实验操作及现象 | 结论 |
A | 淀粉溶液和稀硫酸混合加热后,再加新制的Cu(OH)2悬浊液加热,无砖红色沉淀产生 | 淀粉未水解 |
B | 室温下,向盛有1mL0.2mol·L-1NaOH溶液的试管中滴加2滴0.1mol·L-1MgCl2溶液,产生白色沉淀,再滴加2滴0.1mol·L-1FeCl3溶液,又产生红褐色沉淀 | 室温下,Fe(OH)3的溶解度小于Mg(OH)2 |
C | 向两支试管中分别加入2mL和1mL0.1mol·L-1Na2S2O3溶液,再向盛有1mLNa2S2O3溶液的试管中加入1mL蒸馏水,最后同时向两支试管中加2mL0.1mol·L-1H2SO4溶液,振荡,加入2mLNa2S2O3溶液的试管先出现浑浊 | 其他条件一定时,反应物浓度越大,反应速率越快 |
D | 将SO2通入酸性KMnO4溶液中,取反应后的溶液于试管中,再向试管中加入BaCl2溶液,振荡,产生白色沉淀 | 该环境中SO2的氧化产物为 |


I.制备CoCl2
已知:钴单质与氯气在加热条件下反应可制得纯净CoCl2 , 钴单质在300℃以上易被氧气氧化;CoCl2熔点为86℃,易潮解。制备装置如下:
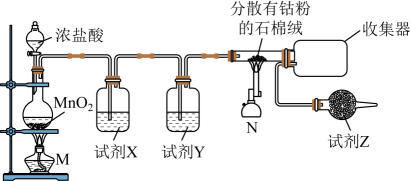
已知:①Co2+不易被氧化;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3在水中的溶解度曲线如图所示:

③加入少量浓盐酸有利于[Co(NH3)6]Cl3析出。
按图组装好装置→(填序号,下同)→打开磁力搅拌器→控制温度在10℃以下→→加热至60℃左右,恒温20min→在冰水中冷却所得混合物,即有晶体析出(粗产品)。

①缓慢加入H2O2溶液
②滴加稍过量的浓氨水
③向三颈烧瓶中加入活性炭、CoCl2、NH4Cl和适量水

已知:i.二价金属氧化物能分别与氨配合生成配离子,如[Fe(NH3)2]2+、[Mn(NH3)2]2+、[Zn(NH3)4]2+;
ii.25℃时相关物质的Ksp如下表:
物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
iii.Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:

①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为(填字母)。
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是(写出一种)。
③混合气体e可返回至“”阶段循环利用。
①该反应在一定温度下能自发进行的原因为。
②已知键能是指气态分子中1mol化学键解离成气态原子所吸收的能量,上述反应中相关的化学键键能数据如下:
化学键 | C-H | C≡O | H-H |
键能/(kJ·mol-1) | 413 | 1075 | 436 |
则CO2(g)=C(g)+2O(g) ΔH=kJ·mol-1。
i.CH4(g)+CO2(g)2H2(g)+2CO(g)
ii.H2(g)+CO2(g)H2O(g)+CO(g) ΔH=+41.2kJ·mol-1
若在恒温、恒容密闭容器中进行反应i、ii,下列事实能说明上述反应达到平衡状态的是____ (填字母)。
①平衡时容器的体积是起始时的倍。
②该温度下反应i的压强平衡常数Kp=(Kp为用分压表示的平衡常数,分压=总压×物质的量分数)。
③维持其他因素不变,若向平衡体系中通入一定量的N2(N2不参与反应),再次平衡后CH4的转化率 (填“增大”“减小”“不变”或“无法判断”,下同),。

在Rh表面,每生成1molCO,则价带产生的空穴(h+)数为NA;价带上的电极反应式可表示为。
反应i:CaCO3(s)CaO(s)+CO2(g)
反应ii:CaO(s)+H2S(g)CaS(s)+H2O(g)
反应iii:CaS(s)+2O2(g)CaSO4(s)
请回答下列问题:
a.σ键b.π键c.离子键d.非极性键

①含有![]() 结构;②能发生银镜反应;③除苯环外,不含其他环符合条件的X共有种,其中核磁共振氢谱有3组峰,且峰面积比为1:2:2的结构简式为。
结构;②能发生银镜反应;③除苯环外,不含其他环符合条件的X共有种,其中核磁共振氢谱有3组峰,且峰面积比为1:2:2的结构简式为。