 B . 称量
B . 称量 C . 量取
C . 量取 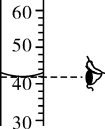 D . 溶解
D . 溶解
每100mL含量(ug/100mL)钙≥400 钠≥20 钾≥10 偏硅酸>150 pH(25℃) 6.8~7.8 |

选项 | 实验现象 | 结论 |
A | 打开浓盐酸瓶盖,瓶口出现白烟 | 浓盐酸化学性质活泼,敞口易分解 |
B | 某金属与盐酸反应比铝与硫酸反应剧烈 | 该金属的活动性比铝的强 |
C | 某无色溶液中滴加无色酚酞试液,呈无色 | 该无色溶液显酸性 |
D | 白磷在热水中不燃烧,通入氧气后燃烧 | 氧气能支持白磷燃烧 |

a.冬季,大气中的CO2凝华为干冰,储存在地表
b.夏季,地表中的干冰升华成CO2 , 释放到大气

①设备1中的能量转化为。
②设备2中发生的化学反应基本类型为。
③炼铁室内发生反应的化学方程式。

炭罐中活性炭的作用是;直饮水机中起到杀菌消毒作用的步骤是(填数字序号)。

①KNO3与NaCl在水中的溶解度曲线如图所示,20℃时,NaCl的溶解度为g。
②KNO3中混有少量NaCl,提纯KNO3可采用的方法是。

①CH4对应的点是。
②b点对应物质充分燃烧后可得到点对应的物质。
③f点对应物质的化学式为,请写出它的一种用途。
①该反应中存在种氧化物。
②通过分析该反应的微观过程,可以获得的信息是(写出一条即可)。
③写出该反应的化学方程式。
【进行实验】
实验操作 | 序号 | 金属 | 实验现象 |
| 甲 | Zn | 60min后,滤纸上长出约1.5cm铜树 |
乙 | Al | 60min后,滤纸上长出约0.8cm铜树 | |
丙 | Mg | 镁片表面有气泡产生,60min后,滤纸上得到少许细碎红色固体 |
【解释与结论】
Mg、Al和Zn三种金属能从溶液中置换出铜的原因是。
【进行实验】利用Ⅰ中装置,在室温下用Zn进行如下实验。
组别 | 第1组 | 第2组 | ||||
序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 | 2-6 |
溶液种类 | CuSO4 | CuSO4 | CuSO4 | CuCl2 | CuCl2 | CuCl2 |
溶液的浓度(%) | 6 | 12 | 18 | 6 | 12 | 18 |
60min后“铜树”长度(cm) | 0.7 | 0.8 | 1.5 | 1.9 | 2.2 | 2.0 |
【解释与结论】
设计实验2-1和2-4的目的是。
结合以上实验,“铜树”的最佳生长条件是。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.11g/cm3)的H2O2溶液体积为mL(计算结果保留一位小数);水为g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中、用量筒量取液体时,视线应与。
③混匀:……。

①实验室用过氧化氢(MnO2作催化剂)制取氧气,选择的发生装置和收集装置为和(填字母),反应的化学方程式为。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,应预先用量筒量取mL的水加入该集气瓶中(空气中氧气的体积分数按20%计算)。
品牌:X盐名称:果蔬洗涤盐 净含量:400g 保质期:五年 储存方法:常温下置于干燥处存放,防潮 配料表:食用精制食盐、食品级pH调节剂 |
【查阅资料】①该品牌果蔬洗涤盐pH调节剂的成分可能是碳酸钠、碳酸氢钠、酒石酸、柠檬酸中的一种或两种。pH调节剂能维持渗透压、控制酸碱平衡。
②大多数农药是酸性的。③碳酸氢钠受热易分解为二氧化碳和碳酸钠等三种物质,碳酸钠则有较高的热稳定性,二者的溶液都显碱性。
实验操作 | 实验现象 | 实验结论 |
①取少许A溶液于试管中,滴加氯化钙溶液 | 有白色沉淀生成 | |
②取适量洗涤盐,加热,将生成的气体通入澄清石灰水 | 观察到 | 证明该pH调节剂中含有碳酸氢钠。 |
请写出上表操作①中反应的化学方程式。
请写出上表操作②中碳酸氢钠分解的化学方程式。
【反思与评价】
①你认为果蔬洗涤盐中pH调节剂的作用是什么。
②该商品配料表中有一处表述不恰当,请你改正过来。