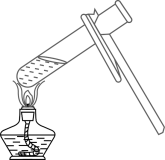
 加热液体
B .
加热液体
B . 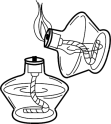 点燃酒精灯
C .
点燃酒精灯
C .  测溶液的pH
D .
测溶液的pH
D .  稀释浓硫酸
稀释浓硫酸
选项 | 实验目的 | 实验操作 |
A | 除去N2中混有的少量O2 | 将混合气体通过灼热的铜网 |
B | 除去铜粉中的铁粉 | 加入足量的稀盐酸,过滤、洗涤、干燥 |
C | 除去KCl固体中少量MnO2 | 加入足量的水溶解,过滤、蒸发结晶 |
D | 除去NaOH溶液中的Na2CO3 | 加入足量的稀盐酸 |

测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 |
pH | 4.95 | 4.94 | 4.88 | 4.86 |
①工业盐酸 ②熟石灰 ③烧碱

温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | |


①反应物的状态 ②气体的性质 ③反应条件

I.
Ⅱ.
下列有关“侯氏制碱法”的说法中错误的是(填字母代号)。
A.反应I中生成物X的化学式为NH4Cl
B.“侯氏制碱法”中的“碱”指的氢氧化钠
C.NaHCO3受热易分解
D.二氧化碳可以循环使用
【查阅资料】1 溶液呈碱性,是因为溶液中存在较多的OH-。
2 Na2CO3在水中全部解离出Na+和CO32-。
3 CaCl2溶液呈中性,Ca2+、Cl-对溶液的碱性没有影响
【提出猜想】猜想一:H2O单独起作用,产生较多的OH- , 使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH- , 使溶液呈碱性。
猜想三:。
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 向盛有蒸馏水的试管滴入2滴酚酞溶液 | 溶液无明显变化 | 。 |
2 | 向盛有NaCl溶液的试管滴入2滴酚酞溶液 | 。 | 猜想二不成立 |
3 | 向盛有Na2CO3溶液的试管滴入2滴酚酞溶液 | 溶液由无色变红色 | 猜想三成立 |
4 | 向实验3所得的溶液中逐滴加入CaCl2溶液至过量 | 。 |
【解释与结论】经与老师交流得知:Na2CO3溶液中部分和H2O作用,产生较多的OH-和另一种阴离子。
小组同学取Na2CO3和NaHCO3固体混合物,充分加热至固体质量不再改变,冷却至室温后,向其中加入100g质量分数为7.3%的盐酸恰好完全反应。则原固体混合物中含钠元素的质量为g。