 B .
B . 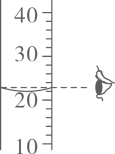 C .
C .  D .
D . 


加入的物质 | 酚酞试液 | Ca(NO3)溶液 | 稀硫酸 |
实验现象 | 溶液变红 | 白色沉淀 | 产生气体 |
物质 | 所含杂质 | 除去杂质的试剂或方法 | |
A | 铁粉 | 铜粉 | 加过量硫酸铜溶液,过滤、洗涤、干燥 |
B | N2 | O2 | 通过灼热的铜粉 |
C | NaOH溶液 | Na₂CO3溶液 | 加适量Ca(OH)2溶液,过滤 |
D | NaCl固体 | 细沙 | 加入足量水溶解,过滤 |

② 一种可以改良酸性土壤的碱。
③ 一种具有挥发性的酸。
④ 一种可以治疗胃酸过多的盐。

①如图实现了能量之间的相互转化,光伏发电板是将太阳能转变为(填“化学能”或“电能”之一)。
②下列符合“碳达峰”、“碳中和”这一主题的做法(填序号)。
a.大力植树造林
b.少开私家车,尽量乘坐公共交通工具
c.提倡使用一次性木筷就餐
③为实现“碳达峰”、“碳中和”,工业上利用甲烷(CH4)在催化剂的作用下“捕获”二氧化碳,生成CO和一种气体单质,以减少碳的排放,该反应的化学方程式为。
④碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:
, 则X的化学式为,B(OH)3中氢元素和氧元素的质量比为。

②铝热剂是铝粉和氧化铁粉末的混合物,引燃铝热剂,发生反应生成铁和氧化铝,此反应用于焊接钢轨,请写出该反应的化学方程式,反应类型属于(选填“化合反应”、“分解反应”、“置换反应”或“复分解反应”之一)。
③除铝合金外,轻轨列车上还使用了铝镁合金、锰钢、玻璃、塑料等材料,以上材料中属于有机合成材料。

①t₁℃时,C物质的溶解度为g;
②t₂℃时,将40gA物质加入50g水中充分溶解后,所得溶液中溶质和溶剂的质量比为。
③将t₂℃时A,B,C三种物质的饱和溶液降低温度到t₁℃时,三种溶液的溶质质量分数由大到小的关系是。
④当A中含有少量B时,为了提纯A,可采用(“降温结晶”或“蒸发结晶”之一)的方法,并简述选择该方法的理由:。

试根据题目要求,回答下列问题:
①所选仪器的连接顺序为(从左到右填写仪器序号字母)。
②制取气体时,必须先进行的操作是;收集二氧化碳时,进行验满的方法是:将燃着的木条放在集气瓶瓶口,若木条,则证明收集已满。
③上述制取二氧化碳的化学方程式为
④若将二氧化碳通入氢氧化钠溶液中,反应后溶液的质量与之前相比会(选填“增大”、“减小”或“不变”之一)。
①请写出仪器A中发生反应的化学方程式。
②仪器E大玻璃管中放入的塑料试样,充分燃烧后,测得仪器B₂的质量增加3.6g仪器C的质量增加8.8g,则该塑料试样中碳、氢元素的质量比为(最简整数比)。
③若装置中没有连接仪器B₁,这样测算出的该塑料试样中氢元素的质量与实际值比较将(选填“偏小”“偏大”或“基本一致”之一)。
A.酱油 B.花生油 C. 白醋 D.矿泉水
②分别取上述两种固体少许于试管中,各滴加①所选溶液,若观察到试管中(填写现象),证明该试管中的物质是面碱。

试根据实验过程和发生的现象,填写以下空白:
①沉淀F的化学式为。
②将气体G通入紫色石蕊试液,试液变色。
③溶液D中,一定存在的阴离子是(填写离子符号)。
④写出步骤③中生成沉淀I的化学方程式。
⑤固体样品B中,一定不存在的物质是(填写化学式),得出此结论的理由是。

②饱和NaCl溶液中通入足量NH3和CO2后,先析出的NaHCO3晶体的原因是(填序号)。
A.溶剂质量减少
B.相同温度下,NaHCO3溶解度小于NH4Cl
C.相同反应时间,生成NaHCO3的质量大于NH4Cl质量
③向饱和食盐水中先通入氨气再通二氧化碳的原因是。

①当滴入稀盐酸溶液80g时(即图中A点),烧杯中溶液里含有的阳离子为(写离子符号)。
②当滴入稀盐酸溶液100g时(即图中B点),恰好完全反应,试通过计算,求纯碱样品中碳酸钠的质量分数(计算结果精确至0.1%)。