选项 | 实验目的 | 实验方案设计 | 现象和结论 |
A | 制备Fe(OH)3胶体 | 向5 mL NaOH溶液中滴加2滴FeCl3饱和溶液,煮沸 | 溶液变红褐色;说明有Fe(OH)3胶体生成 |
B | 验证铁的电化学腐蚀 | 在一 块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置2~3 min | 溶液边缘 出现红色;说明铁发生了吸氧腐蚀 |
C | 探究SO2的还原性 | 将SO2通入适量品红溶液中 | 溶液褪色:说明SO2具有还原性 |
D | 比较C与Cl的非金属性强弱 | 用pH试纸测定1mol/L的Na2CO3和NaClO溶液的pH | 前者的试纸颜色比后者深; 说明非金属性Cl>C |


[Ag(NH3)]++NH3 [Ag(NH3)2]+ K2
Ag+、[Ag(NH3)]+、 [Ag(NH3)2]+ 的分布分数δ与lgc(NH3 )关系如下图所示,下列说法正确的是{例如:分布分数δ(Ag+)=}


已知:金属离子形成氢氧化物沉淀的pH范围[ pH =8.5时Al(OH)3开始溶解]
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ |
开始沉淀时pH | 3.4 | 2.7 | 7.6 | 11.3 |
完全沉淀时pH | 4.7 | 3.7 | 9.6 |
回答下列问题:
![]()

已知:K2MnO4在强碱性溶液中稳定存在。
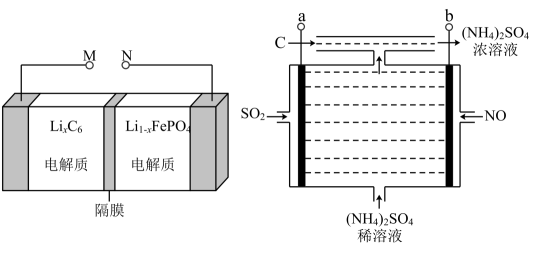
仪器b的名称是 ,使用a的优点是 ,单向阀(只允许气体从左流向右)可以起到的作用是。
步骤1:称取m g FeC2O4晶体样品并溶于稀H2SO4中,配成250mL溶液:
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准溶液滴定至终点:
步骤3:向反应后溶液中加入过量铜粉,充分反应后,过滤、洗涤,将滤液和洗涤液全部收集到锥形瓶中,加入适量稀H2SO4 , 再用c mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液VmL。
步骤2中KMnO4溶液除与Fe2+发生反应外,还与H2C2O4发生氧化还原反应,写出其与H2C2O4反应的离子方程式。
2NH3(g) + H2O(1) + SO2(g)=(NH4)2SO3(aq) ΔH=akJ/mol
2NH4HSO3(aq)=((NH4)2SO3 (aq) + H2O(l) + SO2(g) ΔH =bkJ/mol
2(NH4)2SO3(aq) + O2(g)= 2(NH4)2SO4 (aq) ΔH = ckJ/mol
反应2NH3(g) + 2NH4HSO3(aq)+O2(g)= 2(NH4)2SO4+(aq)的 ΔH = kJ/mol(用含a、 b、c的代数式表示)。
①上述条件下H2S的平衡转化事α1= %。
②若在620 K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH 0(填“<” “>”“<或=”)。
③在610 K时反应H2S(g) + CO2(g) COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是 (填标号)。
A.向容器中通入H2S B.向容器中通入CO2
C.加入催化剂 D.缩小容器的体积

①压强: p2 p1(填:“>”或”<”) :判断的理由是。
②若p1=8.1MPa,起始时充入a mol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp= MPa(用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。

回答下列问题:

 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。